恶性肿瘤晚期容易出现转移,骨是最常见的转移部位之一。对于临床上出现的恶性肿瘤伴骨转移的患者常采用姑息治疗的方式提高患者生活质量,比如放射治疗、化疗、双磷酸盐类药物治疗等[1]。89SrCl2是治疗骨转移最常见的放射性核素之一,在临床治疗中应用广泛。
1 资料和方法 1.1 临床资料选取我院2012年6月至2015年6月期间住院治疗的恶性肿瘤伴多发骨转移的患者为研究对象,76例患者中,男性40例,女性36例,患者年龄在18 ~ 75周岁之间,中位年龄为53岁,均经病理或细胞学确诊,经CT、SPECT、MRI或X射线片等影像学检查证实。肺癌24例,乳腺癌和前列腺癌分别为17和10例,结直肠癌12例,其他部位癌13例,患者明显多发骨痛,白细胞计数大于3.5×109/L,血小板计数大于90×109/L,红细胞计数大于3.5×1012 /L,无严重肝肾功能不全。已进行放化疗而致白细胞和血小板降低的患者,对症治疗稳定30天后再行89SrCl2治疗。对近期进行过化疗而致骨髓极度抑制者,不予治疗。
1.2 方法所有患者接受治疗前停止钙剂治疗,进行血常规、血生化、肝肾功能的检查确定正常,经CT、SPECT、MRI或X射线片等影像学检查证实全身3处以上骨转移灶。静脉留置针下一次性给药,每人每次给药剂量148 MBq,根据病情疗效重复治疗间隔3 ~ 6个月,分别于治疗前和治疗后7天、30天监测血常规、血生化、肝肾功能的变化评价。治疗后2 ~ 3个月行CT、SPECT等影像学复查评价。
1.3 评价指标以毒副反应、患者骨痛缓解率及影像学评估分级缓解程度作为评价指标。
1.3.1 毒副反应根据患者治疗后血常规、肝肾功的情况与治疗前相比较,评价患者采用89SrCl2治疗后的毒副反应。
1.3.2 疼痛缓解率根据世界卫生组织疼痛VRS标准分为4度: 0度,无疼痛; 1度,轻度疼痛,可忍受,不影响正常生活; 2度,中度疼痛,影响睡眠,需采用一般性的止痛药; 3度,剧烈疼痛,伴自主神经功能紊乱,严重影响睡眠,需使用麻醉性药物[2]。疼痛缓解度分为5级: 0级,未减轻; 1级,轻度缓解(减轻1/4); 2级,中度缓解(减轻1/2); 3级,明显缓解(减轻3/4); 4级,完全缓解,疼痛完全消失。疼痛缓解率分为:显效,完全缓解+明显缓解; 有效,中度缓解; 无效为未减轻+轻度缓解; 总有效率是显效和有效的和[3]。
1.4 影像学评价患者影像学评价指标分为四个等级:显效,骨转移所有病灶钙化、体积缩小或消失; 有效,骨转移病灶钙化、缩小或数目减少50%以上; 好转,骨转移病灶钙化、缩小或数目减少25%以上; 无效,骨转移病灶钙化、缩小或数目减少不足25%。影像学评价是有效或无效需两名以上经验丰富的医师做出判断[4]。
1.5 统计方法本实验将所得数据输入统计学软件SPSS 16.0中进行统计学分析。
2 结果 2.1 毒副反应化验结果所有患者采用89SrCl2治疗后7天,血液分析检查结果白细胞、血小板计数较治疗前的数值降低均小于20%,肝肾功的检查结果无明显变化。治疗后30天血常规、肝肾功的检查结果无明显差异。
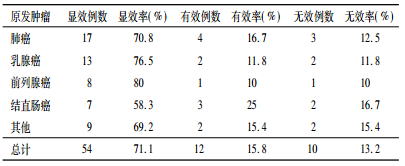
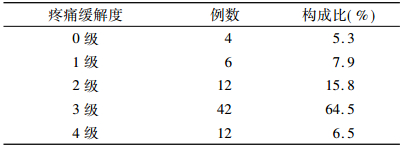
2.2 骨痛缓解结果患者治疗后总体显效率为86.9%,总计54例病例骨痛症状明显缓解,本实验患者均为2度即中度以上疼痛,多数在治疗5天左右开始显效,持续作用时间2 ~ 6个月,治疗后未出现病理性骨折和放射性肺炎症状等,部分患者经89SrCl2治疗后,原转移病灶明显缓解,一段时间后出现新的疼痛部位,影像检查证实为新发骨转移灶。患者总体骨痛缓解率及骨痛恢复情况见表 1和表 2。
|
|
表 1 骨痛缓解率统计 |
|
|
表 2 患者骨痛恢复情况 |
相比于治疗前,显效19例占25%,有效42例占55.3%,好转10例占13.2%,无效4例占5.3%,总有效率80.3%。
3 讨论资料显示[1],大约50%恶性肿瘤在发病后期会有骨转移,不同种类型对应的骨转移几率存在一定的差异性,比如乳腺癌为47% ~ 85%,肺癌骨为30% ~ 55%,前列腺癌为33% ~ 85%等,在骨转移中最常见的转移部位是脊柱、骨盆,这类患者的中位生存期为3个月到12个月不等,尤其是肺癌骨转移患者大多数生存时间较短,在临床诊断中MRI、CT、X射线以及SPECT等都是重要的诊断方式,放射性核素治疗骨转移是有效的,疼痛缓解率60% ~ 80%,中位反应时间2 ~ 4个月。
89SrCl2产生的β射线射程有限,一般不会对人体正常骨髓产生明显损害,因此骨髓抑制作用不明显。有研究显示氯化锶(89SrCl2)的疗效观察中会出现一过性的血液毒性,患者接受治疗后血象略低于正常值,随时间推移各项指标可恢复正常[5]。本研究也证实了此结论,表明单纯行89SrCl2治疗不会产生明显的骨髓抑制,但治疗前已有明显骨髓抑制的患者或外周血检测严重肾功能障碍或全身骨显像时双肾影浓集的患者应慎用。89SrCl2在体内的滞留时间和滞留量与患者血浆清除率大小、骨转移程度有关[6]。
放射性药物镇痛作用可能与三种因素有关[7]: ①射线能使瘤体组织坏死,体积缩小,骨皮质张力减低而止痛; ②辐射能抑制致痛性化学物质碱性磷酸酶和前列腺素的分泌; ③射线能破坏肿瘤组织周围的痛觉传出神经而止痛。氯化锶(89SrCl2)具备独特的物理特性,其衰变类型是β衰变,在软组织内射程为0.8 cm,在骨组织中射程为2 ~ 3 mm,最大能量为1.46 MeV,半衰期50.5 d[8]。骨是锶主要的靶器官,人体摄入的锶99%沉积于骨中,并主要经过肾脏排出[9]。89SrCl2临床上常采用静脉注射的方式,有很好的靶向作用,大部分与骨组织结合,能够在骨转移病灶聚集并起到治疗效果,有效半衰期内可持续对局部病灶产生照射。89SrCl2在骨转移灶的聚集量是正常骨的2 ~ 25倍,注射后90天,在骨转移灶内的滞留量仍可达12% ~ 90%[10],可持久地维持药效,是骨转移瘤首选靶向放射治疗药物。
89SrCl2在人体内的分布情况与全身骨显像检查注射用显像剂99mTc-MDP的趋骨性和体内分布非常相近[9],因此在采用89SrCl2治疗时更适于全身骨显像显示为异常放射性浓聚的病灶。雷奈酸锶对很多动物具有对抗骨吸收和促进骨形成的作用[11],从而达到防治骨质疏松的作用; 在小鼠和大鼠的实验中,雷奈酸锶有增强骨形成和降低骨吸收的作用,并表现为骨量增加[12-13]; 这些证据表明锶不仅可以被成骨性转移灶吸收,还可以被溶骨性转移灶吸收,证明89SrCl2可同时治疗成骨性及溶骨性骨转移。有研究显示部分患者经89SrCl2治疗后,在原转移病灶缓解同时又出现新发骨转移灶,表明89SrCl2虽能治疗已经发现的骨转移灶,却不能预防和延缓新发的骨转移灶,这可能是因为局部骨尚未出现代谢活跃的转移性病灶,89SrCl2不能在此大量聚集和滞留而发挥治疗作用[14]。这也验证了本组出现的类似情况。
综上所述,对于恶性肿瘤且伴随骨转移的患者,提高其生活质量是最主要目的。89SrCl2内放射治疗具备副作用小、操作简单的特点,临床实施的依从性高,在综合治疗中常被作为改善患者生活质量的推荐措施。
| [1] |
谷铣之, 殷蔚伯, 余子豪, 等. 肿瘤放射治疗学[M]. 4版. 北京: 中国协和医科大学出版社, 2008: 1191-1198.
|
| [2] |
张天泽, 徐光炜. 肿瘤学[M]. 天津: 天津科学技术出版社, 1998: 2721-2729.
|
| [3] |
蒋迎九, 李朝先, 向小勇, 等. 泰勒宁胶囊对开胸术后镇痛疗效观察[J]. 中国医院药学杂志, 2003, 23(1): 39-40. DOI:10.3321/j.issn:1001-5213.2003.01.021 |
| [4] |
潘中允. 放射性核素治疗学[M]. 北京: 人民卫生出版社, 2006: 217.
|
| [5] |
张王峰, 叶常青, 袁梦晖, 等. 氯化锶(锶- 90)放疗辐射对肿瘤骨转移患者血象的影响[J]. 华南国防医学杂志, 2010, 24(3): 193-195. |
| [6] |
朱家伦, 刘超, 刘鹏杰, 等. 89 x ± s治疗现状与进展[J]. 中国医药导报, 2010, 7(3): 6-8. DOI:10.3969/j.issn.1673-7210.2010.03.003 |
| [7] |
王萌, 崔亚利. 放射性药物在治疗骨转移瘤中的应用[J]. 实用肿瘤学杂志, 2008, 22(4): 391-392. DOI:10.3969/j.issn.1002-3070.2008.04.034 |
| [8] |
Robinson RG, Preston DF, Schiefelbein M, et al. Strontium 89 therapy for the palliation of pain due to osseous metastases[J]. JAMA, 1995, 274(5): 420-424. DOI:10.1001/jama.1995.03530050068035 |
| [9] |
徐微娜, 贾云静, 张彩霞, 等. 氯化锶(89 x ± s)治疗恶性肿瘤骨转移的临床分析[J]. 现代肿瘤医学, 2008, 16(12): 2175-2177. DOI:10.3969/j.issn.1672-4992.2008.12.054 |
| [10] |
Laing AH, Ackery DM, Bayly RJ, et al. Strontium - 89 chloride for pain palliation in prostate skeletal malignancy[J]. Br J Radiol, 1991, 64: 816-822. DOI:10.1259/0007-1285-64-765-816 |
| [11] |
Marie PJ. Strontium ranelate: a novel mode of action optimizing bone formation and resorption[J]. Osteoporos Int, 2005, 16(Suppl 1): S7-10. |
| [12] |
Marie PJ. Strontium ranelate: a physiological approach for optimizing bone formation and resorption[J]. Bone, 2006, 38(2 Suppl 1): S10-14. |
| [13] |
Ammann P, Shen V, Robin B, et al. Strontium ranelate improves bone resistance by increasing bone mass and improving architecture in intact female rats[J]. J Bone Miner Res, 2004, 19(12): 2012-2020. DOI:10.1359/jbmr.040906 |
| [14] |
魏卫, 吴海江, 鹿存芝. 氯化锶治疗56例肿瘤骨转移疼痛的疗效观察[J]. 中华临床医师杂志, 2010, 4(07): 1132-1133. DOI:10.3969/cma.j.issn.1674-0785.2010.07.062 |