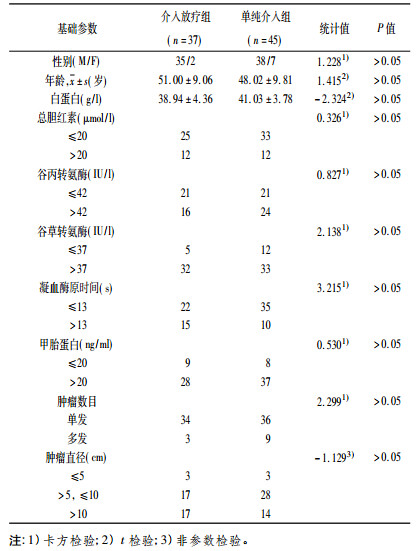
原发性肝细胞癌(Hepatocellular Carcinoma, HCC)是我国常见的恶性肿瘤, 死亡率居恶性肿瘤死亡率第二位。而门静脉癌栓(Portal vein tumor thrombus, PVTT)既可成为转移扩散、术后复发的基础, 又可引起或加剧门静脉高压、顽固性腹水、肝功能衰竭而导致死亡, 是影响肝癌患者预后及分期、分级的重要因素。立体定向适形放疗(Stereotactic Conformal Radiotherapy), 是20世纪90年代后期逐渐成熟起来的技术, 利用加速器使多个射线野等中心照射肿瘤, 每个野的几何形状均与肿瘤的形状一致, 它通过共面或非共面多野照射, 使肿瘤受到高剂量照射, 同时使周围正常组织得到有效保护, 在肝癌等肿瘤治疗的长期实践中已取得显著成效。目前肝癌伴门静脉癌栓适形放疗联合肝动脉插管栓塞化疗(简称介入, Transhepatic arterial chemotherapy and embolization, TACE)是一种新兴的综合性疗法, 我科自2012年8月至2014年8月收治的肝癌合并门静脉癌栓病人82例, 男73例, 女9例; 年龄25 ~69岁, 平均年龄49.4岁, 合并乙肝80例, 合并肝硬化77例, 肝内肿瘤个数1~4个, 肿瘤直径3~18 cm, 平均9.49 cm, 肿瘤位于左叶25例, 右叶57例。Child A级64例、B级18例。两组患者的年龄、性别、癌灶的数目和大小、肝功能情况、AFP情况等在统计学上均无显著性差异(见表 1)。我们将收治的肝癌伴门静脉癌栓患者分为两组:放疗+介入组(简称"联合治疗组")和单纯介入组(简称"介入组")。所有病例均AFP > 20 μg/L, 无远处转移。观察放疗联合介入的疗效, 探讨立体定向适形放疗对肝癌伴门静脉癌栓的治疗效果及临床价值。
|
|
表 1 两组患者基线情况比较 |
治疗药物采用5-Fu 500~1000 mg、表阿霉素15~20 mg、碘油5~10 ml。其中用表阿霉素和超液化碘油制成混悬液对肝内癌灶及门脉瘤栓进行栓塞, 术后一周行门静脉瘤栓的放疗, CT定位, 放疗应用医科达公司5880直线加速器立体定向同步挡块法(多叶光栅)适形放疗, 剂量率为1.0 Gy/min。单次剂量为200~220 cGy/d, 每周5次, 瘤栓总剂量为40 ~55 Gy, DT40 Gy时用CT测量肿瘤体积变化情况。全部患者连同体部固定架经螺旋CT定位机以3~5 mm层厚靶区连续扫描。根据计算机工作站重建的图像勾画肿瘤体积、向外扩5~10 mm勾画计划靶体积, 重建三维图像, 根据肿瘤体积, 每个肿瘤设1个靶点, 精确描画靶区, 选择射线入射方向, 优化剂量分布, 使90%等剂量线包绕90%以上的病灶体积。
1.2 观察指标治疗前和治疗后化验血常规、AFP、定期行肝脏B超作为治疗期间毒副反应的观察指标。所有患者从治疗结束后开始, 均随访1~2年, 每3个月复查肝脏CT或MRI, 根据PVTT可测量病灶评价疗效, 全疗程治疗结束后1~3个月评价近期客观疗效, 随访期结束后评价远期客观疗效, 并计算1年生存率。
1.3 临床疗效标准按WHO《实体瘤测量标准》分为:完全缓解(CR), 部分缓解(PR), 稳定(SD)和进展(PD)。有效率(RR)为CR+PR (例)/总例数× 100%。远期疗效按生存率、总体生存时间评价、治疗生存期自患者介入治疗开始之日起计算。
1.4 统计学方法所有计量资料采用均数±标准差表示(x ± s), 数据分析采用SPSS 13.0统计分析软件, 两组计数资料比较采用χ2检验, 两组计量资料比较采用t检验, 以P < 0.05为差异有统计学意义。
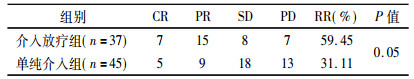
2 结果 2.1 近期客观疗效比较随访截至2014年12月, 随访时间为2~20个月, 随访率100%。近期疗效:联合治疗组有效率为59.45%;介入组有效率为31.11%, 两组间差异有统计学意义(P < 0.05), 见表 2。
|
|
表 2 两组患者近期疗效比较 |
两组患者均完成治疗, 联合治疗组患者随访期内20例死亡, 单纯介入组患者随访期内41例死亡。联合治疗组1年生存率显著高于单纯介入组, 两组间差异有统计学意义(P < 0.05), 见表 3, 两组患者总体生存期差异有统计学意义(P < 0.05), 见图 1。

|
图 1 两组患者总体生存时间比较 |
|
|
表 3 两组患者远期客观疗效比较 |
两组均不同程度降低, 联合治疗组比介入组下降明显, 但无统计学差异(P > 0.05)。
2.4 不良反应及治疗后肝功生化指标变化两组患者治疗期间多数有不同程度的消化道反应, 表现为恶心、呕吐、纳差、腹胀等, 未见上消化道出血及严重呕吐, 对症治疗后均可缓解。两组患者均未发生严重的肝损害, 治疗结束后肝功生化指标变化无显著差异(P > 0.05)。
3 讨论原发性肝癌, 是指肝细胞或肝内胆管细胞所发生的癌肿。临床以肝区持续性疼痛与肝脏进行性肿大为其表现特点。本病为我国常见恶性肿瘤之一, 可发生于任何年龄, 以40~49岁最多, 男:女=2~5:1。年龄40~49岁为高发, 我国高发地区为江苏启东、广西扶绥, 世界范围内则以非洲撒哈拉沙漠以南及亚洲太平洋沿岸地区为高发区。原发性肝癌病死率高, 近年来随着外科和影像技术的进步, 肝癌的预后有了一定程度的改善, 但国内外大宗流行病学资料提示, 近二三十年肝癌的整体生存率并未有实质性提高[1-2], 主要原因是70%~80%肝癌患者就诊时已经处于进展期或晚期(国际巴塞罗那BCLC分期为C期和D期), 合并门静脉癌栓发生率高, 进展快, 预后差。
肝癌在发生发展过程中侵犯其相邻门静脉, 易形成门静脉癌栓, 肝癌病人一旦形成门静脉癌栓, 病情发展迅速, 很快形成门静脉高压、腹水、黄疸、肝外转移, 中位生存时间仅为2.8个月。目前公认PVTT是肝癌预后不良的主要危险因素, 是影响肝癌患者整体疗效的"瓶颈"。大多数HCC合并PVTT患者在就诊时己失去外科手术切除治疗的机会, 若单独采用保守治疗, 预后极差。目前对于PHC合并PVTT尚无有效的治疗方法。近年来随着医学的进步, 介入治疗、三维适形调强放射治疗、生物治疗、微波热凝射频消融术等多种治疗方法已应用于HCC的治疗, 但总体疗效仍然不满意。因此, 寻找有效的治疗方法成为急需解决的问题。
放疗联合TACE是治疗不可切除HCC合并PVTT患者的趋势, 有研究认为HCC合并PVTT时, 如行TACE治疗可能导致肝脏缺血坏死, 导致肝功损害加重。但也有研究[3]认为, 合并PVTT时可以导致门静脉周围小静脉扩张而建立侧支循环, 经过血管造影可见与门静脉平行的小静脉丛, 因此TACE治疗不会引起肝脏的严重缺血。本研究中对照组45例原发性肝细胞癌合并PVTT患者采用单纯TACE治疗, 患者治疗后1年生存率仅为8.89%。由于肝脏是由门静脉和肝动脉双重供血的器官, TACE仅能阻断瘤体及癌栓的动脉供血, PVTT仍然保留了门静脉血供, 因此不能完全杀灭癌栓内的肿瘤细胞[4]。
三维适形放射治疗的主要特点是放射治疗照射野形状在三维空间与肿瘤形状一致, 在提高靶区剂量的同时, 明显降低周围正常组织的受照射量, 最大限度的保护正常组织, 从而提高近期疗效和生存率, 目前已是肝癌放射治疗的主流技术, 已被用于合并PVTT的肝癌患者[5]。因此, 笔者在TACE治疗的基础上再给予3DCRT治疗, 结果治疗近期和远期客观疗效、1年生存率、总体生存时间均显著高于对照组(P < 0.05)。在过去的20年, 世界范围内治疗HCC的经验在不断发展, 今天高超的适形技术, 能有效保护患者的肝脏, 使受损的肝脏被更加精确的治疗, 联合TACE治疗或者系统化疗应该不断探索, 保证相对其他治疗模式放射治疗的有效性, 或者评估联合治疗的额外获益。TACE和3DCRT相结合, 能够克服TACE的治疗缺点, 同时利用3DCRT精确定位和精确治疗的优势, 在TACE治疗基础上进一步治疗, 可提高疗效, 延长生存期。此外, 在TACE治疗后1周左右开始3DCRT治疗, 使患者得到适当休息的同时, 又不给肿瘤生长或转移的机会[6]。因此, 笔者认为, 3DCRT联合TACE治疗HCC合并PVTT患者临床疗效肯定, 毒副反应小, 患者均可耐受, 3DCRT联合TACE治疗肝癌合并门静脉癌栓是一个极具潜力的治疗方案, 值得临床推广应用。
| [1] |
Venook AP, Papandreou C, Furuse J, et al. The incidence and epidemiology of hepatocellular carcinoma:a global and regional perspective[J]. Oncologist, 2010, 15(Suppl 4): 5-13. |
| [2] |
Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. DOI:10.3322/caac.v61:2 |
| [3] |
周俭, 肖永胜, 樊嘉. 肝癌合并门静脉癌栓的研究进展[J]. 中国普外基础与临床杂志, 2012, 19(3): 243-246. |
| [4] |
Peng BG, He Q, Li JP, et al. Adjuvant transcatheter arterial chemoembolization improves efficacy of hepatectomy for patients with hepatocellular carcinoma and portal vein tumor thrombus[J]. Am J Surg, 2009, 198(3): 313-318. DOI:10.1016/j.amjsurg.2008.09.026 |
| [5] |
Yamada K, Lzaki K, Sugimoto K, et al. Prospective trial of combined transcatheter arterial chemoembolization and three-dimensional conformal radiotherapy for portal vein tumor thrombus in patients with unresectable hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2003, 57(1): 113-119. DOI:10.1016/S0360-3016(03)00434-6 |
| [6] |
Catalano OA, Choy G, Zhu A, et al. Differentiation of malignant thrombus from bland thrombus of the portal vein in patients with hepatocellular carcinoma:application of diffusion-weighted MR imaging[J]. Radiology, 2010, 254(1): 154-162. |