2. 广东医学院分析中心
2. Guangdong Medical College Analysis Center
随着核能事业的不断发展,人们利用放射性核素解决日常生活遇到的困难和问题的事例越来越多[1]。甲状腺具有高度摄取和浓集131I的能力,所以利用131I治疗甲状腺功能亢进(甲亢)是最常用的方法[2]。许多碘-131标记物的生物学分布研究证明在小鼠体内标记物主要经过肝代谢,骨、肌肉和血液中放射性分布较低[3-4]。多数学者通过碘-131的标记物研究某一物质在小鼠体内的分布,但它不能反映游离碘-131在小鼠组织和器官的分布状况,笔者通过直接腹腔注射不同剂量碘-131的方法,检测每克组织和器官摄取注射剂量百分率(% ID/g) [5-6],分析小鼠组织和器官碘-131的生物学分布,为碘-131的临床应用和降低其副作用提供有价值的实验资料。
1 材料与方法 1.1 动物昆明雄性小白鼠25只,4 ~ 6周龄,体重(20 ± 2) g,南方医科大学动物中心提供。
1.2 试剂及仪器① 碘[131I]化钠溶液由成都中核高通同位素股份有限公司提供,碘[131I]化钠溶液为无色透明液体,放射化学纯度为99.1%,放射性浓度为2.26 GBq/ml (61.2 mCi/m1),放射性核素半衰期为8.04天。将碘[131I]化钠溶液用生理盐水稀释成4 × 106 Bq/ml的溶液,然后再稀释成4 × 101 Bq/ml、4 × 102 Bq/ml、4 × 103 Bq/ml的溶液。②生理盐水、1 ml医用带针注射器、医用手术刀片,镊子。③γ-计数仪(FJ-2008PS):西安核仪器厂。
1.3 分组处理4 × 101 Bq/ml、4 × 102 Bq/ml、4 × 103 Bq/ml、4 × 106 Bq/ml四种浓度的碘-131溶液给予小鼠腹腔注射的量分别为每次0.5 ml/只。因为小鼠体重为(20 ± 2) g,所以上述四种浓度的碘-131可以写成2 × 101 Bq/20 g、2 × 102Bq/20 g、2 × 103 Bq/20 g、2 × 106 Bq/20 g,即1 Bq/g、10 Bq/g、100 Bq/g和105 Bq/g的碘-131放射性比活度。将15只昆明小鼠随机分为A、B、C、D、E五组,每组5只。A组为空白对照组,未进行任何处理; B、C、D、E组小鼠预先分别给予生理盐水、1 Bq/g、10 Bq/g、100 Bq/g的碘-131腹腔注射。12 h时,B、C、D、E组小鼠再给予105 Bq/g的碘-131腹腔注射,每次给予小鼠腹腔注射的试剂容量为每只小鼠0.5ml,B、C、D、E组小鼠给予105 Bq/g的碘-131腹腔注射后24 h与A组小鼠一起颈椎脱臼处死。
1.4 放射性测量五组小鼠颈椎脱臼处死前,每只小鼠采用摘眼球法取血,每只小鼠约取血1ml。采血后颈椎脱臼处死小鼠,剪开小鼠胸腹部皮肤,打开胸腹腔,取每只小鼠的肝脏、脾脏、心脏、骨、胸腺、肺脏、肌肉、肠,分别用电子天平称取各器官重量,然后用γ计数器测量各器官CPM值,并计算每克组织百分注射剂量率(% ID/g),了解碘-131在小鼠体内的分布。
每克组织百分摄取率(% ID/g,即每克组织的放射性计数/注入的总放射性计数× 100%)
1.5 统计学方法本实验所有数据采用SPSS 17.0软件,非参数的随时区组检验,定量资料描述用x±s表示。
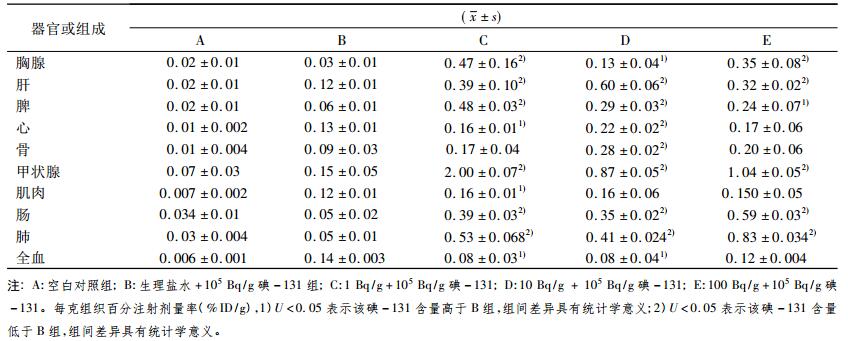
2 结果从表 1可以看出,正常小鼠甲状腺、肠、肺、肝、胸腺、脾、骨、心、肌肉、全血的每克组织百分摄取率依次降低(附表中A组); 碘-131单一剂量组105Bq/g小鼠甲状腺、全血、心、肝、肌肉、骨、脾、肺、肠、胸腺的每克组织百分摄取率依次降低(附表中B组); 1 Bq/g低剂量+ 105 Bq/g高剂量小鼠甲状腺、肺、脾、胸腺、肝、肠、骨、心、肌肉、全血的每克组织百分摄取率依次降低(附表中C组); 10 Bq/g低剂量+ 105 Bq/g高剂量小鼠甲状腺、肝、肺、肠、脾、骨、心、肌肉、胸腺、全血的每克组织百分摄取率依次降低(附表中D组); 100 Bq/g低剂量+ 105 Bq/g高剂量小鼠甲状腺、肺、肠、胸腺、肝、脾、骨、心、肌肉、全血的每克组织百分摄取率依次降低(附表中E组)。各组均显示甲状腺组织内碘-131含量最高,其次为肺、肠、肝、胸腺和脾等组织和器官(附表)。除全血外,C、D和E三组小鼠甲状腺、心、肝、脾、胸腺等器官碘-131含量高于单纯给予105 Bq/g碘-131的小鼠,各组间差异具有统计学意义(P<0.01,P<0.05); 1 Bq/g + 105 Bq/g和10 Bq/g + 105 Bq/g两组小鼠的全血碘-131含量低于单纯给予碘-131的小鼠各组间差异具有统计学意义P<0.05)。
|
|
表 1 131I在小鼠体内生物学分布 |
放射性碘-131作为临床治疗人体甲状腺功能亢进的理想方法,主要机制是利用甲状腺具有高度摄取和浓集131I的能力及131I释放β射线对甲状腺产生损伤效应,破坏甲状腺滤泡细胞,从而使甲状腺分泌甲状腺素减少[2]。本实验各组均显示甲状腺组织内碘-131含量最高,说明甲状腺具有高度摄取和浓集131I的能力与文献结论相符合(附表)。姜士芹[3]等利用放射性碘-131标记Iodogen(四氯二苯基甘脲)基因重组巨噬细胞移动抑制因子(131I-rMIF),体外研究肝癌细胞系H22摄取131I-rMIF的情况。131I-rMIF在荷瘤模型小鼠体内的生物学分布结果显示,小鼠经尾静脉注射131I-rMIF后,分别在0.5、1、3、6、24 h 5个时间点获得实验数据。各时相结果表明,肝脏和双肾放射性较高,表明131I-rMIF主要经过肝肾代谢; 骨和封闭后的甲状腺放射性摄取较少; 荷瘤鼠与正常鼠的生物学分布相似,除肝肾外,各时相的肿瘤放射性摄取均高于其他组织器官。陈波[4]等通过碘-131标记白藜芦醇探讨白藜芦醇在小鼠体内的分布代谢,动物实验显示,静脉注射给药后131I-白藜芦醇在体内分布广泛,血清除较快,肝、肾和肠中分布较高。揭示了131I-白藜芦醇在体内主要经肝、肾代谢; 131I-白藜芦醇在肠中10分钟后达到峰值,其% ID/g达11.70,30分钟后代谢较快,2小时后和血液基本达到平衡。甲状腺的放射性摄取率随时间的延长而增加,注射131I-白藜芦醇4小时后,甲状腺的摄取率达164.14 ± 33.78。上述实验表明131I标记物在甲状腺含量高,多数经过肝肾代谢,其它组织器官分布比较少。但是,由于以上两篇文献中131I是作为标记物与大分子物质结合的,所以131I标记物在体内的分布情况并不能代表131I在小鼠体内的实际分布状况。本实验是利用游离131I直接腹腔注射入小鼠体内,从而可以较结合131I的大分子物质更能反应131I在小鼠体内的生物学分布。本实验结果显示105Bq/g碘-131单一剂量组小鼠甲状腺、全血、心、肝、肌肉、骨、脾、肺、肠、胸腺的每克组织百分摄取率依次降低(附表B组),说明105 Bq/g碘-131给予小鼠24 h后,碘-131在小鼠体内的分布以甲状腺、全血、心、肝为主,与131I标记物相似的是在甲状腺和肝脏游离131I含量也较高,不同的是游离131I在血液和心脏含量较高,这可能是由于131I标记物大分子物质与游离131I在体内分布的差异造成的。预先给予小鼠低剂量(1 Bq/g、10 Bq/g、100 Bq/g)碘-131,12 h再注射高剂量(105 Bq/g)碘-131,随着总注射剂量的增加,引起小鼠体内各器官碘-131的分布随之变化,甲状腺、肝、肺、肠、脾的碘-131含量始终较心、骨、肌肉含量高,说明甲状腺、肝、肺、肠、脾的吸收碘-131的能力较强,心、骨、肌肉吸收碘-131能力弱(表 1)。预先给予小鼠1 Bq/g、10 Bq/g、100 Bq/g的碘-131,再给予105 Bq/g的碘-131,除全血外,C、D、E组各组织和器官的碘-131含量大于单纯B组,说明预先给予小鼠的1 Bq/g、10 Bq/g、100 Bq/g的碘-131与随后给予的105 Bq/g的碘-131在全血之外的组织和器官发生协同作用(表 1)。Myriam[5]等选用碘-131治疗前后病人血样,随后在体外照射0.5和1 Gy的60Co γ射线。结果显示治疗后人外周血淋巴细胞微核率显著低于治疗前,表明治疗剂量的碘-131能够诱导人外周血淋巴细胞产生拮抗γ射线的损伤作用。本实验C、D两组小鼠全血碘-131含量低于单纯高剂量B组(表 1),说明预先给予小鼠1 Bq/g、10 Bq/g碘-131在小鼠血液中产生了碘-131滞留血液内的拮抗作用,此结果与Myriam的实验结果相同。这种发生在小鼠血液内拮抗作用说明小鼠血液内发生了适应性反应,从而使血液内碘-131含量减少,但具体机制还需进一步实验研究。
| [1] |
孙尧, 于杰, 房学东. 碘-131在甲状腺疾病中的应用[J]. 中国地方病防治杂志, 2012, 27(5): 391-392. |
| [2] |
梁保辉, 王旭, 章斌, 等. 131I治疗甲亢时主要器官剂量率的实验研究[J]. 中国辐射卫生, 2010, 19(3): 298-299. |
| [3] |
姜士芹, 张超, 梁婷, 等. 131I-rFliC荷瘤小鼠体内生物学分布及肿瘤靶向性研究[J]. 山东大学学报(医学版), 2012, 50(1): 82-88. |
| [4] |
陈波, 俞惠新, 谭成, 等. 碘标白藜芦醇及其小鼠体内分布[J]. 原子能科学技术, 2008, 42(6): 509-511. |
| [5] |
Myriam A Monsieurs, Hubert M Thierens, Anne M Vral, et al. Adaptive Response in Patients Treated with 131I[J]. Dierckx J Nucl Med, 2000, 41(1): 17-22. |
| [6] |
Charlotta Lundh, Ulrika Lindencrona, Anneli Schmitt, et al. Biodistribution of Free 211 At and 125I in Nude MiceBearing Tumors Derived from Anaplastic Thyroid Carcinoma[J]. Cell Lines CANCER BIOTHERAPY & RADIOPHARMACEUTICALS, 2006, 21(6): 591-600. |