2. 苏州大学医学部免疫学系;
3. 江南大学附属医院(无锡市第四人民医院)病理科
2. Department of Medicine, Soochow University;
3. Pathological Department, Affiliated Hospital of Jiangnan University
淋巴瘤是一组起源于淋巴结和(或)结外淋巴组织的免疫细胞恶性肿瘤, 近几年来发病率呈上升趋势。恶性淋巴瘤在病理上分为霍奇金淋巴瘤(Hodgkin lymphoma, HL)和非霍奇金淋巴瘤(Non-Hodgkin lymphoma, NHL)两大类, NHL占总淋巴瘤的80%左右, 绝大多数为B淋巴细胞来源, 是临床上较难诊断的疾病之一, 误诊率可高达30%[1]。共刺激分子CD80在免疫应答、自身免疫性疾病及肿瘤免疫中均起到重要作用[2-3]。有研究发现[4-5], 一些恶性B淋巴细胞可高表达CD80分子, 且该分子介导的信号与肿瘤细胞的恶性增殖及转移相关。4E5是近年来研制出的针对CD80分子的单克隆抗体, 它与高表达CD80的B淋巴瘤细胞Raji和Daudi有较高的亲和力[6]。4E5的获得为检测细胞表面CD80分子的表达, 提供了良好的工具。本研究在利用B淋巴细胞杂交瘤技术获得单克隆抗体4E5的基础上, 用131I标记该抗体并探讨标记物在荷淋巴瘤裸鼠模型体内的放射免疫显像。
1 材料与方法 1.1 材料单克隆抗体4E5及人B淋巴瘤Raji细胞由苏州大学医学部免疫学系提供, Iodogen由美国Sigma公司提供, Na131I由成都中核高通同位素股份有限公司提供, BALB/C裸鼠由中国科学院上海实验动物中心提供(4周龄, 体质量16~20g)。CRC-15R放射性活度计由美国Capintec公司生产, GC-911γ放射免疫计数器由安徽中科中佳科学仪器有限公司生产, 5810R高速冷冻离心机由德国eppendorf公司生产, SKYLight SPECT仪由荷兰PHILIPS公司生产。
1.2 131I标记单克隆抗体4E5及鉴定 1.2.1 Iodogen法131I标记4E5在含有50 μg Iodogen的反应管中依次加入4E5单抗100 μg、Na131I溶液74 MBq, 轻轻摇动, 室温条件下反应8 min; 反应毕, 加入0.05 mol/L PB液250 μl, 将反应液移入另一管中, 静置5 min。将反应混合物用SephadexG-50层析柱纯化, 用0.05 mol/L pH7.4的PBS洗脱, 收集洗脱液每管0.5 ml, 测定各管的放射性计数, 直至第二高峰洗脱至本底, 合并第一个放射性峰溶液即为产品峰。用三氯醋酸(TCA)沉淀法测定标记率和放化纯度。
1.2.2 标记抗体的免疫活性测量配制细胞数分别为1 × 108、1 × 109、1 × 1010、5 × 1010、1 × 1011个/L的Raji细胞悬液, 各取100 μl细胞悬液加入离心管中, 每个浓度点做3管; 每管加入20 μl的131I-4E5溶液(约5 × 104计数/min), 混匀, 37℃培养2 h; 然后加0.05 mol/L pH7.4的PBS 500 μl, 摇匀, 4℃低温离心10 min (2000 rpm/min, 离心半径12 cm), 吸出上清液, 用PBS洗涤沉淀2次, 测沉淀的放射性计数, 计算细胞结合率; 同时做非特异结合对照管:取各浓度细胞悬液100 μL加入离心管中, 均设3支复管, 先加入2μL非标记的抗体(1 g/L), 然后加入20 μL的标记抗体, 其余步骤同上。特异性结合率(%)=总细胞结合率(%)-非特异性细胞结合率(%)。
1.2.3 标记抗体的稳定性观察将标记抗体分别加入到血清及0.05 mol/L pH 7.4的PBS液中, 置于37℃条件下, 分别于放置1天、2天、3天后测定其放射化学纯度。
1.3 荷人淋巴瘤裸鼠模型的建立采用皮下种植的方法, 裸鼠接种瘤细胞前一天给予一次性3 Gy γ射线照射, 将处于对数生长期的Raji细胞悬液按每只1 × 107个接种于裸鼠右侧腋窝皮下。待肿瘤长至长径1 cm左右时用于实验。
1.4 荷瘤裸鼠SPECT显像和体内分布3只荷瘤裸鼠给药前三天每天用质量分数10%的碘化钾溶液200 μl灌胃, 每只荷瘤裸鼠尾静脉注射131 I-4E5抗体7.4 MBq/0.2 ml, 分别于注射后24、48和72 h进行SPECT显像。显像时将裸鼠用体积分数10%的水合氯醛麻醉, 采用高能平行孔准直器, 能峰364 keV, 窗宽20%, 放大倍数2.2, 采集总计数为300 k。用感兴趣区(ROI)技术进行半定量分析, 计算肿瘤与非肿瘤组织的放射性计数比值(T/NT)。72 h显像结束后处死裸鼠, 分别取血液、心、肝、脾、肺、肾、胃、肠、胰腺、肌肉、骨、甲状腺、脑和肿瘤组织, 称重并用γ计数仪测量放射性计数, 经物理衰变校正后计算各脏器及肿瘤组织的每克组织百分注射剂量率(% ID/g), % ID/g=组织的比放射性活度(cpm/g)/注入标记物的放射性活度(cpm)× 100%。
1.5 统计学处理数据以x ± s表示, 采用SPSS 14.0软件进行统计学分析, 单因素方差分析进行组间两两比较, P < 0.05为差异有统计学意义。
2 结果 2.1 单抗4E5的131I标记结果本方法131I标记4E5的标记率为(78.3 ± 2.4)%, 放射化学纯度为(95.7 ± 1.8)%, 产品131I-4E5的比活度为579.4 MBq/mg。
131I-4E5抗体与Raji细胞的结合率见图 1。131I- 4E5与Raji细胞的结合率随细胞数的增加而增加, 当细胞数达到5 × 106个以后则增加不明显, 最大结合率为(36.1 ± 2.6)%。
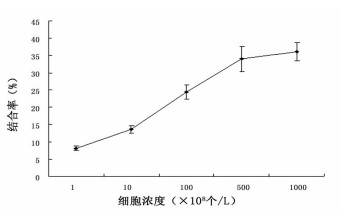
|
图 1 131I-4E5与Raji细胞的结合率 |
131I-4E5加入到血清及PBS中, 放置一定时间的放化纯度见表 1。在37℃条件下放置3天后, 其放化纯度仍大于90%, 说明标记产物有较好的稳定性。
|
|
表 1 131I-4E5在37℃条件下放置不同时间的放化纯度(%) |
注药后24 h荷瘤裸鼠右侧腋下肿瘤部位可见放射性浓聚, 肿瘤突出于正常轮廓之外(图 2)。随着时间的延长, 肿瘤部位浓聚逐渐增加, 显影越来越清晰。72 h肿瘤显影最为清晰, 与周围组织的对比度最明显, ROI半定量分析所得T/NT值为3.2。
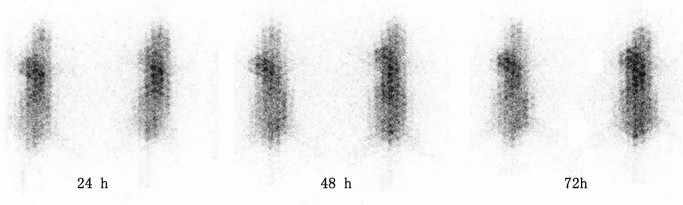
|
图 2 荷瘤裸鼠不同时间点的放射免疫显像图 |
裸鼠血液、心、肝、脾、肺、肾、胃、肠、胰腺、肌肉、骨、甲状腺、脑和肿瘤组织的每克组织百分注射剂量率(% ID/g)分别为:10.42 ± 1.72、2.23 ± 0.58、2.63 ± 0.33、3.32 ± 0.68、4.29 ± 1.02、2.58 ± 0.38、1.05 ± 0.09、1.43 ± 0.20、2.49 ± 0.26、0.90 ± 0.09、1.65 ± 0.40、4.30 ± 0.28、0.29 ± 0.05和5.37 ± 0.55。肿瘤/肌肉比值最大为7.32。
3 讨论放射免疫显像是将放射性核素标记到抗体上, 以特定抗原靶点作为目标, 借助标记抗体与相应抗原的特异性结合来进行功能显像, 可以发现其他显像方法不能显示的微小病灶, 在肿瘤的早期诊断、靶向治疗中发挥重要的作用。目前针对淋巴瘤以CD20为靶点的放射免疫显像的研究已有报道[7-8], 而对于CD80为靶点的相关研究报道甚少。CD80在B淋巴瘤细胞表面有较高的表达, 据文献报道[6], 其阳性表达率可高达92.7%, 且该分子介导的信号与肿瘤细胞的恶性增殖及转移相关。
本研究在利用B淋巴细胞杂交瘤技术获得抗CD80单克隆抗体4E5的基础上, 采用Iodogen法将131I标记到4E5上。Iodogen是一种温和的氧化剂, 利用其化合物不溶于水的特性, 将碘化反应置于液相与固相(氧化剂)之间, 因此只将反应后液相与固相分离, 即可自行终止反应, 无需加入还原剂, 故蛋白质碘化反应过程的损伤较小。本方法131I标记4E5的标记率为(78.3 ± 2.4)%, 放射化学纯度为(95.7 ± 1.8)%。131I-4E5加入到血清及PBS液中, 在37℃条件下放置3天后, 放化纯度仍大于90%, 说明标记产物有较好的稳定性, 符合体内外示踪技术的要求。131I -4E5与人B细胞淋巴瘤Raji细胞的结合率为(36.06 ± 2.63)%, 表明131I标记后的4E5能保持较高的免疫活性。
放射免疫显像可以很直观地显示肿瘤部位的放射性浓聚情况, 本研究中荷瘤裸鼠注射131I-4E5后, 24 h肿瘤部位可见放射性浓聚, 肿瘤突出于正常轮廓之外。显像早期全身血本底较高, 可能是抗体与血液中蛋白结合后滞留在血液内所致, 随着注入131I-4E5时间的延长, 肿瘤部位浓聚逐渐增加, T/NT逐步增高, 显影越来越清晰。72 h肿瘤显影最为清晰, 与周围组织的对比度最明显, ROI半定量分析所得T/NT值最大达到3.2, 可以将72 h作为最佳的显像时间。
本研究利用131I对CD80的单克隆抗体4E5进行了标记, 其标记率和放化纯度较高, 标记物稳定性好。131I-4E5在体外对Raji细胞有较高的亲和力, 在荷瘤裸鼠体内具有肿瘤靶向定位能力, 且在瘤内滞留时间较长, 获得了良好的放射免疫显像图像, 这为进一步利用131I-4E5进行B细胞淋巴瘤CD80为靶点的放射免疫治疗奠定了基础。
| [1] |
徐晓晶, 吴叔明. 21例原发性肠道非霍奇金淋巴瘤误诊分析[J]. 胃肠病学, 2012, 17(6): 325-328. DOI:10.3969/j.issn.1008-7125.2012.06.002 |
| [2] |
Fuse S, Zhang W, Usherwood EJ. Control of memory CD8+T cell differentiation by CD80/CD86-CD28 costimulation and restoration by IL-2 during the recall response[J]. Immunol, 2008, 180(2): 1148-1157. DOI:10.4049/jimmunol.180.2.1148 |
| [3] |
ShinT, Kennedy G, Gorski K, et al. Cooperstive CD80/2(CD80/CD86) and B7-DC costimulation of CD4+T cells independent of the PD-1 receptor[J]. Joural of Experimental Medcine, 2002, 198(1): 31-38. |
| [4] |
Suvas S, Singh V, Sahdev S, et al. Distinct role of CD80 and CD86 in the regulation of the activation of B cell lymphoma[J]. J Biol Chem, 2002, 277(10): 7766-7775. DOI:10.1074/jbc.M105902200 |
| [5] |
Chaperot L, Plumns J, Jacos MC, et al. Functional expression of CD80 and CD86 allows immunogenicity of malignant B cells from non-Hodgkins lymphomal[J]. Exp Hematol, 1999, 27(5): 479-485. |
| [6] |
邱玉华, 季玉红, 郭玲, 等. 鼠抗人B7-1分子功能性单克隆抗体的制备及生物学特性[J]. 中国免疫学杂志, 2000, 16(11): 589-593. DOI:10.3321/j.issn:1000-484X.2000.11.006 |
| [7] |
Erwin WD, Esmaeli B. Estimation of yttrium-90 Zevalin tumor-absorbed dose in ocular adnexal lymphoma using quantitative indium-111 Zevalin radionuclide imaging[J]. Nucl Med Commun, 2009, 30(9): 681-686. DOI:10.1097/MNM.0b013e32832a6e4d |
| [8] |
Shah SQ, Khan AU, Khan MR. (99m) Tc (CO)(3)-Ibritumomab tiuxetan:a novel radioimmunoimaging (RⅡ) agent of B cell non-Hodgkin's lymphoma (NHL)[J]. Biol Chem, 2012, 393(1-2): 71-75. |



