日本"3.11"大地震后福岛核电站核泄漏事故再次将核辐射及核安全的话题引入公众的视线。随着核技术在军事和民用领域的广泛应用, 核辐射导致急性放射病(acute radiation sickness, ARS)的危险加大, 骨髓型ARS的主要病理变化是骨髓造血严重抑制, 因血小板(platelet, PLT)及白细胞(white blood cell, WBC)减少引起的出血及感染是ARS患者死亡的主要原因。近年来文献[1-3]报道白细胞介素12(interleukin 12, IL-12)可促进骨髓抑制小鼠各系祖细胞的增殖和分化。我们前期工作表明重组鼠白细胞介素12(recombinant murine interleukin 12, rmIL-12)能够促进ARS小鼠造血系统, 尤其是巨核系的恢复[4-5]。本实验旨在通过rmIL-12 5、10、20、40、60 μg/kg不同给药剂量对ARS小鼠的治疗效果, 观察rmIL-12对ARS小鼠的防护效果。
1 材料和方法 1.1 实验动物及分组雄性BALB/C小鼠84只, 6~ 8周龄, 体重19~21 g, 购于军事医学科学院实验动物中心, 动物质量合格证号:SCXK-(军)2007-004。根据体重随机分为照射对照组(Control, 不给予rmIL-12治疗)、rmIL-12 5、10、20、40、60 μg/kg治疗6组, 每组14只, 置SPF级清洁动物房带层流架鼠盒中饲养, 每盒7只动物(固定一盒用于血象检测, 另一盒用于造血细胞集落培养), 给予动物中心配置标准块料, 消毒自来水置笼侧自由饮用。动物实验设施合格证号: SYXK-(军)2007-004。
1.2 主要药物、试剂与仪器rmIL-12(10 μg/支, 生产批号:0306S97, 美国PeproTech公司); 甲基纤维素培养基(#03434, 加拿大StemCell公司); MD-175型CO2培养箱(日本Sanyo公司); XS-800i全自动血液分析仪(日本Sysmex公司); CX41型光学倒置显微镜(日本Olympus公司); GWXJ80型60Co远距离治疗机, 中国核动力研究设计院设备制造厂生产。
1.3 照射条件相同条件下, 分别给予6组小鼠60Co γ射线一次全身照射6.0 Gy, 照射剂量率为187 cGy/min, 照射距离均80 cm。
1.4 给药时间及方式rmIL-12用无菌磷酸盐缓冲液(phosphate buffered saline, PBS)稀释配制为0.5、1、2、4、6 μg/ml, 于照射后1 h及照后每3天给药1次, 共5次, 每只小鼠腹腔注射0.2 ml, 照射对照组小鼠注射等量的无菌PBS。
1.5 一般情况及外周血细胞计数每天2次观察小鼠活动状态、大便等情况, 照射前和照射后每3天测量1次小鼠体重, 同时6组各取7只小鼠采尾静脉血30 ~40 μl检测外周血细胞计数。
1.6 骨髓细胞集落培养照射后14、28天每组各取3只小鼠, 颈椎脱臼处死, 无菌条件下分离股骨, 用培养液冲出骨髓细胞, 计数, 将其制成2.0 × 106个/ml的细胞悬液, 取0.3 ml与3.0ml M3434培养基按1:10的体积比混匀后分入3个35 mm培养皿中, 总体积1.1 ml/皿, 细胞终浓度为2.0 × 105个/皿, 每组骨髓细胞培养3个皿, 放置于37℃ 5% CO2培养箱培养12天, 倒置显微镜观察CFU-Mix数(>500个细胞且包括粒细胞、红细胞、巨噬细胞和巨核细胞为1个CFU-Mix集落)。
1.7 数据处理实验数据采用SPSS 12.0统计软件分析, 外周血象进行重复测量方差分析统计学处理, 集落培养结果进行ANOVA分析, 各组结果均以x ± s表示, P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况照射后小鼠活动量不同程度减少, rmIL-12治疗组小鼠精神及活动度均好于对照组, 照射后第3天小鼠体重均不同程度下降, 照后第7天最低, 但治疗组与对照组差异无统计学意义(P ﹥0.05), 第17天小鼠体重均恢复至照射前基础水平。
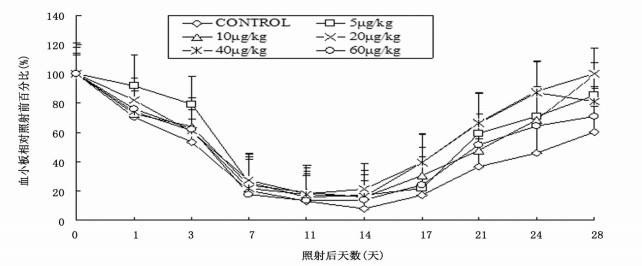
2.2 外周血小板计数照射后第1天对照组小鼠PLT即明显下降, rmIL-12治疗组小鼠PLT下降速度慢于对照组, 照后第1、3天各治疗组PLT均高于对照组, 治疗组PLT最低值13.9%~21.5%, 均高于对照组(8.1%, P < 0.01)。5、20μg/kg治疗组PLT于照射后第11天开始恢复, 对照组及10、40、60 μg/kg组为第14天。各治疗组PLT恢复速度均快于对照组, 20 μg/kg治疗组恢复速度最快。照后第28天5、10、20、40、60 μg/kg治疗组PLT分别恢复至照射前PLT值的85.5%、99.3%、100.2%、80.9%、70.7%, 均高于对照组(60.4%, P < 0.01)(图 1)。
|
图 1 rmIL—12不同给药剂量对6.0 Gy60Coγ射线照射小鼠外周血血小板的影响(n = 7) |
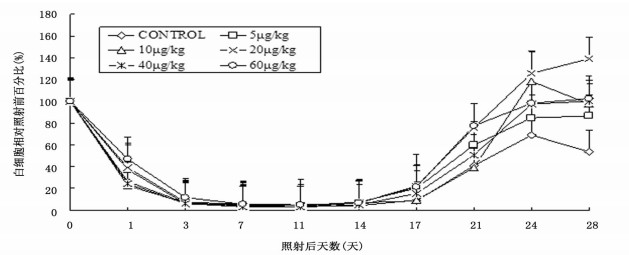
小鼠照射后第1天WBC明显下降, rmIL-12治疗组与对照组WBC均在照后第11天降至最低点。照后第17天5、20、40、60 μg/kg治疗组WBC数开始高于对照组(P < 0.05), 10 μg/kg治疗组第24天WBC数开始高于对照组(P < 0.05), 第24和28天对照组WBC分别为68.9%和53.7%, 治疗组分别为85%~125.9%和86.4%~139.2%, 20 μg/kg治疗组高于其他治疗组(P < 0.05)(图 2)。
|
图 2 rrmIL-12不同给药剂量对6.0 Gy60Coγ射线照射小鼠外周血白细胞的影响(n=7) |
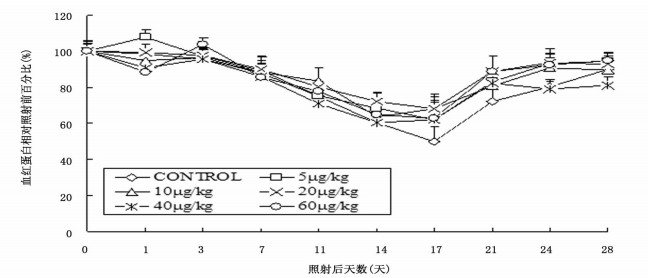
照射后血红蛋白(hemoglobin, HGB)下降速度较慢, rmIL-12治疗组与对照组HGB均在照后第17天降至最低点, 治疗组HGB最低值(62.0%~68.3%)高于对照组(49.9%)(P < 0.01)。照后28天5、10、20、60 μg/kg治疗组HGB恢复至89.9%~94.8%, 高于对照组(89.8%, P > 0.05), 40 μg/kg治疗组HGB为81.2%, 低于对照组(P < 0.05)(图 3)。
|
图 3 rrmIL-12不同给药剂量对6.0 Gy60Coγ射线照射小鼠外周血红蛋白的影响(n=7) |
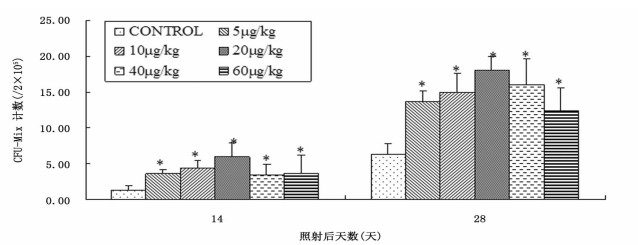
照射后第14天小鼠有核细胞培养结果表明, rmIL-12治疗组小鼠CFU-Mix均高于对照组(P < 0.01), 20 μg/kg治疗组高于其他治疗组(P < 0.05)。照后第28天治疗组CFU- Mix为对照组的195%~284%(P < 0.01), 20 μg/kg治疗组高于其他治疗组(P < 0.05)(图 4)。
|
图 4 rmIL-12不同给药剂量对6.0 Gy60Coγ射线照射小鼠CFU-Mix (/2 × 105细胞)的影响(n=3) 注:*P < 0.01, 与Control组比较。 |
近年来国内外对骨髓型ARS治疗方法的研究有长足进展[4-5], 但对于血小板严重减少除了输注新鲜血小板外尚无更加有效的治疗药物。我们前期实验已经观察了rmIL-12对ARS小鼠造血系统, 尤其是巨核系的影响。本实验主要研究rmIL-12对ARS小鼠的最佳防护剂量。结果显示rmIL-12 5、10、20、40、60 μg/kg治疗后, ARS小鼠的一般情况较对照组均改善, 治疗组PLT最低值较对照组均增高, 20 μg/kg治疗组PLT < 50%的持续时间较对照组明显缩短, 恢复速度快于其他剂量及对照组。治疗组WBC < 50%持续时间较对照组均缩短, 20 μg/kg治疗组WBC恢复速度快于其他治疗组。治疗组HGB最低值均高于对照组, 第28天5、10、20、60 μg/kg治疗组HGB稍高于对照组, 40 μg/kg治疗组低于对照组。骨髓细胞集落培养结果提示, rmIL-12 5、10、20、40、60 μg/kg均显著促进骨髓细胞形成CFU-Mix, 20 μg/kg治疗组优于其他治疗组。后续实验中, 我们将rmIL-12 20 μg/kg联合粒细胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)应用于ARS小鼠的治疗, 结果显示联合治疗后, ARS小鼠WBC恢复时间较对照组明显提前(7天vs 11天), WBC恢复速度与单独应用G-CSF相当; PLT开始恢复时间较对照组明显提前(11天vs 14天), 且PLT最低值明显高于对照组(16.5% vs 8.1%), PLT恢复速度与单独应用rmIL -12相当; HGB开始恢复时间较对照组提前(14天vs 17天), 且HGB最低值明显高于对照组(69.5% vs 49.9%)。骨髓细胞集落培养结果亦提示, rmIL-12联合G-CSF治疗显著促进ARS小鼠骨髓细胞形成CFU -GM及CFU-Mix, 提示rmIL-12联合其他造血因子对ARS小鼠也具有较好的治疗作用。
关于rmIL-12促进造血恢复的机制, 与早期研究认为rmIL-12发挥刺激造血作用需要与其他生长因子联合应用[6]不同, 近年来发现rmIL-12单独应用也具有促进造血恢复作用。rmIL-12可能不仅作用于定系分化的造血祖细胞, 也作用于具有多系分化潜能的造血干细胞, 从而有效促进外周血象三系的恢复。单独照射前给药能够有效降低外周血细胞, 尤其是PLT受照后下降幅度, 这种"辐射保护作用"可能是通过诱导造血祖细胞进入对辐射最不敏感的细胞分裂S期来实现[7]。Chen等发现rmIL-12治疗后小鼠干细胞抗原-1(Sca-1)阳性细胞明显高于对照组, Sca-1是HSC表面标志物, 同时骨髓中间充质干细胞、表皮祖细胞及成骨祖细胞等组成骨髓微环境的细胞表面也有表达[8-9], 因而rmIL-12这种促进造血恢复的作用也可能是通过保护并恢复受损的骨髓微环境来实现。实验中发现, rmIL-12促进ARS小鼠外周血象恢复及骨髓有核细胞形成CFU-Mix的能力并未随着rmIL-12剂量的增加而持续增强, 可能与rmIL-12剂量超过一定程度后单纯增加rmIL-12的剂量, 从而诱发γ干扰素(interferon-γ, IFN-γ)的产生, 继而导致外周血细胞计数的减少和骨髓造血功能的降低有关[10], 具体机制需进一步实验验证。本研究为IL-12在ARS的治疗中用药剂量的确定提供了实验依据。
| [1] |
Chen T, Burke KA, Zhan Y, et al. IL-12 facilitates both the recovery of endogenous hematopoiesis and the engraftment of stem cells after ionizing radiation[J]. Exp Hematol, 2007, 35(2): 203-213. DOI:10.1016/j.exphem.2006.10.002 |
| [2] |
Basile LA, Gallaher TK, Shibata D, et al. Multilineage hematopoietic recovery with concomitant antitumor effects using low dose interleukin-12 in myelosuppressed tumor-bearing mice[J]. J Transl Med, 2008, 6: 26. DOI:10.1186/1479-5876-6-26 |
| [3] |
Basile LA, Ellefson D, Gluzman-Poltorak Z, et al. HemaMax, a Recombinant Human Interleukin-12, Is a Potent Mitigator of Acute Radiation Injury in Mice and Non-Human Primates[J]. PLoS One, 2012, 7(2): e30434. DOI:10.1371/journal.pone.0030434 |
| [4] |
Drouet M, Herodin F. Radiation victim management and the haematologist in the future:time to revisit therapeutic guidelines[J]. Int J Radiat Biol, 2010, 86(8): 636-648. DOI:10.3109/09553001003789604 |
| [5] |
Donnelly EH, Nemhauser JB, Smith JM, et al. Acute radiation syndrome:assessment and management[J]. South Med J, 2010, 103(6): 541-546. DOI:10.1097/SMJ.0b013e3181ddd571 |
| [6] |
Ploemacher RE, van Soest PL, Boudewijn A, et al. Interleukin-12 enhances interleukin-3 dependent multilineage hematopoietic colony formation stimulated by interleukin-11 or steel factor[J]. Leukemia, 1993, 7(9): 1374-1380. |
| [7] |
Herodin F, Drouet M. Cytokine-based treatment of accidentally irradiated victims and new approaches[J]. Exp Hematol, 2005, 33: 1071-1080. DOI:10.1016/j.exphem.2005.04.007 |
| [8] |
Baddoo M, Hill K, Wilkinson R, et al. Characterization of mesenchymal stem cells isolated from murine bone marrow by negative selection[J]. J Cell Biochem, 2003, 89(6): 1235-1249. DOI:10.1002/(ISSN)1097-4644 |
| [9] |
Shaw JP, Basch R, Shamamian P. Hematopoietic stem cells and endothelial cell precursors express IL-22, CD31 and CD45[J]. Blood Cells Mol Dis, 2004, 32(1): 168-175. |
| [10] |
Eng VM, Car BD, Schnyder B, et al. The stimulatory effects of interleukin (IL)-12 on hematopoiesis are antagonized by IL-12-induced interferon gamma in vivo[J]. J Exp Med, 1995, 181(5): 1893-1898. DOI:10.1084/jem.181.5.1893 |


