2. 广西医科大学第一附属医院放疗科;
3. 广西壮族自治区人民医院生殖中心实验室;
4. 广西壮族自治区人民医院内分泌代谢干部病区;
5. 北海市人民医院血液科;
6. 柳州市工人医院妇产科
头颈肿瘤患者在接受放化疗等综合治疗后常常可以获得长期生存, 但在随访的第1个5年期, 每年仍有(3~6)%的患者发生第二原发肿瘤(secondary primary tumor, SPT), SPT是该患者人群患病和主要死亡原因[1-3]。遗传基因的稳定性被认为是SPT的重要原因之一[4]。本研究拟通过分析既往有头颈肿瘤放化疗病史、现已发生以及未发生SPT患者的外周血淋巴细胞对致突变剂博莱霉素的敏感性, 探讨基因的稳定性与SPT的发生风险。
1 材料与方法 1.1 研究对象收集2008年6月~2013年6月经组织学证实为SPT、既往有头颈部恶性肿瘤病史、曾采用根治性放疗±化疗治疗的患者, 设为SPT组。成功随访的、既往有头颈肿瘤放疗±化疗病史、现已治愈而至随访之日尚未发生SPT的患者, 设为非SPT组。病例来源于广西壮族自治区人民医院、广西医科大学第一附属医院、北海市人民医院、柳州市工人医院等多家三甲医院。所有病例均除外高血压、2型糖尿病、慢性肝病、慢性肾病、免疫系统疾病、慢性阻塞性肺病、哮喘等合并症以及既往有头颈部良性肿瘤病史者。
1.2 SPT的定义以Warren和Gates建立的标准[5]① 新的肿瘤的组织学类型与原发肿瘤不相同; ②相同组织学类型的出现须为原发肿瘤治疗后> 3年; ③距离原发肿瘤、有正常上皮细胞间隔> 2 cm。
1.3 致突变剂博莱霉素敏感性分析① 清晨、空腹和清醒的状态下采集入组病例和健康对照者外周静脉血2 mL, 500 U/μmol肝素抗凝。严格无菌操作, 按1:9的比例将采集的外周静脉血加入外周血淋巴细胞培养基中(湖南湘雅基因技术有限公司提供, 批号: 200902140202), 置于循环消毒CO2培养箱(美国Therno电子公司, 型号:HEPA CLASS 100)中37℃培养72 h。0.03 U/mL博莱霉素(日本化药公司提供)干预5 h。40 μg/mL秋水仙碱0.08 mL阻断2 h。低速离心7 min, 20 r/min。去上清液, 加入0.075 mmol/L的KCL溶液5 mL, 混匀。后置37℃电热三用水浴箱(Q/ZYS 002-91型号BS60)中15 min。乙酸:甲醇(成都市科龙化工试剂厂提供)按1:3的比例配成固定液。第一次加入1 mL进行预固定, 吹打、混匀后低速离心, 条件20 r/min, 7min。去上清液后再加入5 mL固定液固定、吹打、离心。如此重复1次。去上清液, 滴管取少量含有淋巴细胞的混悬液滴于冰片上, 酒精灯烤片, 玻片标记编号。每一样本制片4张。将制好的玻片置于电热鼓风箱(湖北黄石市医疗器械厂, 型号DFG801)中3 h。胰酶消化5~7 min, Giemsa染色。②已标记编号的玻片由2名以上专门的技术人员进行读片。计算每个样本50个有丝分裂中期的染色单体断裂的数目, 并以±s表达为每个细胞染色单体的平均断裂数。选择有完整46条染色体, 形态相对较好于辨认的染色体进行观察、计数。
1.4 统计学分析计量资料以x±s表示, 两样本的差异比较采用t检验, 多个样本的差异比较采用方差分析和秩和检验。应用SPSS 13.0软件包, 所有检验水准均为0.05。
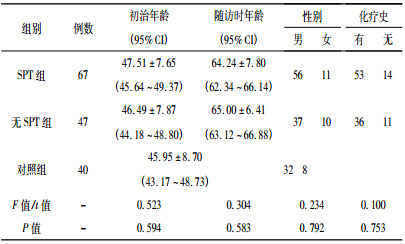
2 结果 2.1 入组病例及确诊为SPT并成功采集外周血进行致突变剂敏感性分析的患者有67例, 非SPT组患者47例, 既往均有头颈部放疗病史, 选择年龄相似的正常人40例作为对照组。SPT组患者从初诊断头颈肿瘤到发生SPT的时间为[(16.73±6.31)年, 95% CI:15.19~ 18.27)年], 而无SPT组最后随访之日距初诊断头颈肿瘤的时间为[(18.51±8.51)年, 95% CI:16.01~21.01)年], 差异无统计学意义(F=1.643, P=0.203)。发生SPT的部位主要是头颈(20/67)、肺(18/67)、前列腺(9/ 67)、结直肠(7/67)和膀胱(3/67), 病理类型以鳞癌居多(36/67), 也有腺癌、肉瘤、腺样囊性癌、肌上皮癌等。SPT组和无SPT组初治肿瘤部位主要是鼻咽部(58/ 114)、喉(24/114)、下咽(13/114)、舌(10/114), 病理类型也以鼻咽未分化非角化性癌(53/114)和鳞癌(38/ 114)为主。入组病例及对照组的病例资料见表 1。
|
|
表 1 两组患者一般资料比较(x±s) |
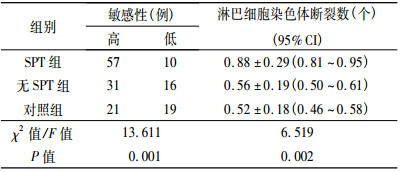
SPT组、无SPT组和对照组的外周血淋巴细胞平均染色单体断裂数差异有统计学意义, SPT组显著高于无SPT组和对照组, 但是无SPT组和对照组差异无统计学意义(t=0.975, P=0.332)。以≥ 0.5个断裂数/细胞作为博莱霉素敏感性高低的分界点[6], 3组对博莱霉素敏感的百分比分别为85.07%(57/67)、65.96%(31/47)、52.50% (21/40), 差异有统计学意义。见表 2。
|
|
表 2 两组患者对致突变剂博莱霉素的敏感性分析(x±s) |
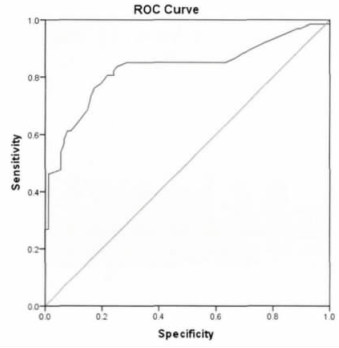
将SPT组设置为病例组, 另两组设定为对照组对外周血淋巴细胞平均染色单体断裂数进行ROC曲线分析, 见图 1。ROC曲线下面积为0.829, 面积的标准误是0.037, 外周血淋巴细胞平均染色单体断裂数用于判断发生SPT的风险有统计学意义(P=0.000)。从ROC的移动诊断界点, 选取ROC曲线上距离左上角最近的点作为诊断界点, 参考Youden指数[7]:(灵敏度+特异度-1), 0.69是特异性和敏感性最佳的点, 灵敏度为0.806, 特异度为0.782。
|
图 1 ROC曲线图 |
尽管宿主患癌易感性与致癌物的环境暴露之间的相互作用已经明确, 但是环境诱变剂的个体反应性有很大差别。可能的原因有:①致癌物代谢的个体间差异; ②诱变剂或致癌物导致的染色体损伤的易感性; ③不同的DNA修复能力[8-13]。化疗药物和放射线治疗都可以诱发SPT。研究表明辐射至少可以通过3个机制导致癌症的发生:①与可导致DNA损伤和突变的遗传毒性药物的机制相似; ②在中等或高剂量, 辐射细胞杀伤作用破坏组织和约束控制变异细胞增殖的效能减低; ③通过诱导慢性放射损伤(组织凋亡或无序的高增殖)[14]。SPT的原因至今仍不完全清楚, 可能的原因有:遗传易感性, DNA修复能力的降低和基因不稳定性的增加将导致患癌风险增加。其次为环境因素、生活方式和治疗相关因素等导致。然而长期以来, 我们都低估了SPT事件发生的时间。大多数癌症患者的随访期是5~10年, 而SPT却很少在这个期间内发生。治疗诱导性SPT已成为早期头颈癌患者死亡的主要原因[15]。
本研究采用博莱霉素作为致突变剂分析既往有头颈肿瘤病史患者的基因稳定性与接受物理和/或化学治疗后是否发生SPT做了一个回顾性分析。由于国内大多数医疗单位或院所的病例资源无法共享, 因此本研究最大的困难在于获取病例, 尤其是治愈多年而未发生SPT的患者。本研究SPT组患者从初诊断头颈肿瘤经放疗±化疗治疗后到发生SPT的时间为(16.73±6.31)年, 选取随访时间相仿而未发生SPT、既往有头颈肿瘤病史、并经过放疗±化疗治疗的患者作为病例对照组, 同时设置正常对照组, 使结果更具有说服力。研究发现, SPT组对致突变剂敏感性显著高于无SPT组和对照组, 提示宿主基因稳定性与发生SPT密切相关。外周血淋巴细胞平均染色单体断裂数判断该患者人群发生SPT的风险有价值, ≥ 0.69可以作为高危SPT患者的临界参考值。本研究是一个横断面调查, 入组病例较少, 生存分析、多因素分析等均存在较大的统计学偏倚, 能否将该值作为预判初治头颈肿瘤患者放化疗后发生SPT的风险有待进一步验证。
中国南方是头颈肿瘤高发的区域, 尤其是鼻咽癌, 治愈率高, 生存期长, 尤其要重视SPT的发生。对于高危SPT的患者在初始治疗制定治疗计划时是否应该把放疗的剂量、靶区、时间和化疗等各种因素都考虑进去进行个体化治疗, 避免或降低过度治疗导致的SPT, 我们还有更多的工作需要去做。因此在本地区开展大型多中心前瞻性研究意义重大而深远。采用博莱霉素作为致突变剂检测基因的稳定性, 灵敏度和特异性均较好, 技术成熟稳定, 成本低, 效价值高, 易于在基层医院推广, 同时又具有较好的经济前景。
| [1] |
Khuri FR, Kim ES, Lee JJ, et al. The impact of smoking status, disease stage, and index tumor site on second primary tumor incidence and tumor recurrence in the head and neck retinoid chemoprevention trial[J]. Cancer Epidemiol Biomarkers Prev, 2001, 10(8): 823-829. |
| [2] |
Haughey BH, Gates GA, Arfken CL, et al. Meta analysis of second malignant tumors in head and neck cancer:the case for an endoscopic screening protocol[J]. Ann Otol Rhinol Laryngol, 1992, 101(2 Pt 1): 105-112. |
| [3] |
Gluckman JL, Crissman JD. Survival rates in 548 patients with multiple neoplasms of the upper aerodigestive tract[J]. Laryngoscope, 1983, 93(1): 71-74. |
| [4] |
Li X, Hemminki K. Familial upper aerodigestive tract cancers:incidence trends, familial clustering and subsequent cancers[J]. Oral Oncol, 2003, 39(3): 232-239. DOI:10.1016/S1368-8375(02)00091-X |
| [5] |
Warren S, Gates O. Multiple primary malignant tumors.A survey of the literature and a statistical study[J]. Am J Cancer, 1932, 16: 1358-1414. |
| [6] |
Wu X, Gu J, Dong Q, et al. Joint effect of mutagen sensitivity and insulin-like growth factors in predicting the risk of developing secondary primary tumors and tumor recurrence in patients with head and neck cancer[J]. Clin Cancer Res, 2006, 12(23): 7194-7201. DOI:10.1158/1078-0432.CCR-06-0671 |
| [7] |
Hilden J, Glasziou P. Regret graphs, diagnostic uncertainty and Youden's Index[J]. Stat Med, 1996, 15(10): 969-986. DOI:10.1002/(ISSN)1097-0258 |
| [8] |
Wu X, Shi H, Jiang H, et al. Associations between cytochrome P4502E1 genotype, mutagen sensitivity, cigarette smoking and susceptibility to lung cancer[J]. Carcinogenesis, 1997, 18(5): 967-973. DOI:10.1093/carcin/18.5.967 |
| [9] |
Kawajiri K, Watanabe J, Eguchi H, et al.Genetic polymorphisms of drug-metabolizing enzymes and lung cancer susceptibility[J].Pharmacogenetics, 1995, 5 Spec No: S70-73. https://www.ncbi.nlm.nih.gov/pubmed/7581493
|
| [10] |
Nakachi K, Imai K, Hayashi S, et al. Polymorphisms of the CYP1A1 and glutathione S-transferase genes associated with susceptibility to lung cancer in relation to cigarette dose in a Japanese population[J]. Cancer Res, 1993, 53(13): 2994-2999. |
| [11] |
Setlow RB. Repair deficient human disorders and cancer[J]. Nature, 1978, 271(5647): 713-717. DOI:10.1038/271713a0 |
| [12] |
Bohr VA, Phillips DH, Hanawalt PC. Heterogeneous DNA damage and repair in the mammalian genome[J]. Cancer Res, 1987, 47(24 Pt 1): 6426-6436. |
| [13] |
Hsu TC. Genetic instability in the human population:a working hypothesis[J]. Hereditas, 1983, 98(1): 1-9. |
| [14] |
Welte B, Suhr P, Bottke D, et al. Second malignancies in high dose areas of previous tumor radiotherapy[J]. Strahlenther Onkol, 2010, 186(3): 174-179. DOI:10.1007/s00066-010-2050-4 |
| [15] |
Larson JT, Adams GL, Fattah HA. Survival statistics for multiple primaries in head and neck cancer[J]. Otolaryngol Head Neck Surg, 1990, 103: 14-24. DOI:10.1177/019459989010300103 |