2. 中国医学科学院放射医学研究所, 天津市分子核医学重点实验室;
3. 中国医学科学院肿瘤医院检验科
2. Tianjin Key Laboratory of Molecular Nuclear Medicine, Institute of Radiation Medicine, Chinese Academy of Medical Sciences;
3. Department of Clinical Laboratory, Cancer Hospital, Peking Union Medical College&Chinese Academy of Medical Sciences
食管癌是一种常见的恶性肿瘤, 食管癌患者治疗后平均5 a存活率低于25%[1]。食管癌包括食管鳞状细胞癌和食管腺癌两种类型, 相对于西方国家以腺癌为主, 食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)是中国的主要类型[2]。而放射治疗是ESCC的主要治疗手段, 在现阶段食管癌治疗中应用极为普遍。然而, 放射治疗后期, 食管癌患者肿瘤组织放疗耐受性的产生, 成为严重影响放疗疗效的主要因素, 大大降低了患者的生存率。因此, 寻找食管癌细胞相关的放疗耐受或放射敏感基因, 调节其表达, 以提高放射敏感性, 是目前提高放疗疗效的有效手段。
miRNA是一类高度保守的非编码单链小RNA, 含有19~22个核苷酸。miRNA可以通过与靶基因mR- NA的3'UTR相结合, 在转录后水平干扰基因的表达或影响其mRNA稳定性, 从而降低蛋白水平[3]。研究表明多种miRNA起到癌基因或抑癌基因的作用。miRNA表现出对细胞周期、细胞增殖、细胞凋亡、细胞转移和侵袭、新陈代谢、血管生成、肿瘤微环境、肿瘤免疫等各方面的调节作用。miRNA可能成为肿瘤放射敏感性调节的新靶点。本次研究中, 我们将采用体外稳定转染细胞模型, 来研究miRNA-22的表达与食管鳞状细胞癌(ESCC)放射敏感性的关系。
1 材料与方法 1.1 细胞培养食管癌细胞EC9706(购自中美合资博慧斯生物医药科技有限公司)用含有10%胎牛血清的RPMI 1640培养基, 置于37℃、5% CO2的培养箱中培养。
1.2 γ射线照射用137 Cs γ射线照射EC9706细胞, 根据实验设计照射不同剂量, 剂量率为1.0 Gy/min, 源靶距为15 cm。
1.3 质粒构建和细胞转染miRNA-22正义表达载体(含有miRNA-22前体序列的pSuppressorNeo重组质粒, 购自ABI公司, 下文称空载组+miRNA-22), 含有一段无义寡核苷酸序列的重组载体转染作为阴性对照组(下文称空载组)。Anti-miRTM miRNA-22抑制剂(购自ABI公司)可以用来敲降miRNA-22的表达。将上述正义表达载体、RNAi载体及阴性对照组通过Lipofectamine 2000(购自Invitrogen公司)转染进入EC9706细胞。northern blots用来检测转染效果。
1.4 miRNA northern blots从组织中提取的总RNA, 通过15%的变性聚丙烯酰胺凝胶电泳。转移至杂交膜, 并与寡核苷酸探针(与miRNA-22互补、末端标记T4多核苷酸激酶的寡核苷酸片段)结合。42℃杂交过夜。用42℃的0.1 × SSPE和0.1%× SDS洗膜两次, 每次15min。用Typhoon 9410成像。以5sRNA作为内参。
1.5 克隆形成实验照射后EC 9706细胞以400个细胞/孔的密度接种于6孔板中, 37℃, 5% CO2条件下培养10 d, 弃去培养基, PBS洗两次, 加入甲醇, 固定10 min。弃去固定液, 姬姆萨染色20 min, 倒置显微镜下观察细胞克隆并计数各孔50个以上的集落数。
1.6 MTT法检测细胞增值活性照射后EC 9706细胞采用MTT法检测不同分组的细胞增殖活性的变化。细胞计数后以3 × 103/孔的细胞浓度接种于96孔板中, 每组设3个复孔。在37℃, 5% CO2条件下培养8 h。取出培养板, 每孔加入MTT溶液10 μl (10 μg/ml), 继续培养4 h。吸去孔内培养基, 每孔加入二甲亚砜(DMSO)150 μl, 震荡10 min, 使结晶充分溶解。选择490 nm波长, 酶联免疫检测仪测定各孔吸光值, 并把各组此时的生长率定为0。此后每隔1 d (24 h)检测1次, 记录吸光度(A)值。
1.7 统计学分析结果以x ± s表示, 采用SPSS 16.0统计软件对结果进行t检验。P < 0.05为差异有统计学意义。
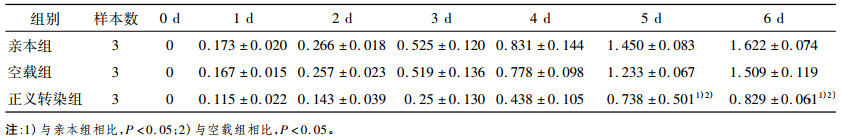
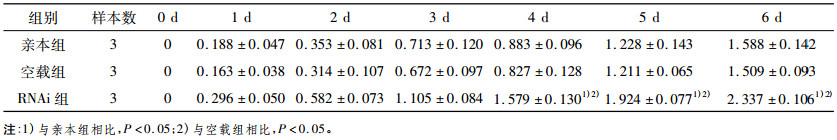
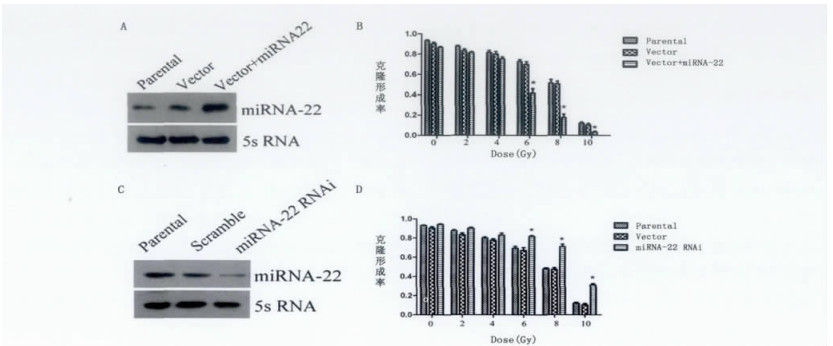
2 结果 2.1 miRNA-22的表达对食管癌细胞放射敏感性的影响MTT法结果表明, 6 Gy照射后, miRNA-22表达升高的EC9706细胞增殖能力比对照组降低(P < 0.05), 见表 1。而miRNA-22表达降低的EC9706细胞克隆形成能力比对照组升高(P < 0.05), 见表 2。用miRNA northern blots法检测转染效果。通过克隆形成实验和MTT法来检测miRNA-22表达改变对食管癌细胞放射敏感性的影响。Northern blots结果显示, miRNA-22正义载体(Vector+miRNA-22)和干扰载体(Vector+miRNA-22i)都成功转染, 分别升高或降低了EC9706细胞中miRNA-22的表达见图 1A、C 。克隆形成实验结果表明, 经过6、8、10 Gy照射后, miR- NA-22表达升高的EC9706细胞克隆形成能力比对照组降低(P < 0.01), 见图 1B 。而miRNA-22表达降低的EC9706细胞克隆形成能力比对照组升高(P < 0.01), 见图 1D 。
|
|
表 1 miRNA-22正义转染对照射后不同时间EC9706细胞增殖活力的影响(A值, x ± s) |
|
|
表 2 miRNA-22 RNAi对照射后不同时间EC9706细胞增殖活力的影响(A值, x ± s) |
|
图 1 miRNA-22的表达对食管癌细胞放射敏感性的影响 A:miRNA-22正义转染后, miRNA-22表达量升高; B:经过6、8、10Gy照射后, miRNA-22表达量升高的EC9706细胞克隆形成率比对照组显著降低(P < 0.01);C:miRNA-22 RNAi载体转染后, miRNA-22表达量降低; D:经过6、8、10Gy照射后, miRNA-22表达量降低的EC9706细胞克隆形成率比对照组显著升高(P < 0.01)。 |
miRNA是近年来人们研究的热点。目前人们发现的miRNA前体约有25000种, 能调控人类基因组中约30%的基因[4]。研究表明miRNA在多种癌症中, 如淋巴癌、大肠癌、肺癌、乳房癌、肝癌、胶质母细胞癌和胃癌[5]有着异常表达, 并在肿瘤细胞的发生、侵袭等多种细胞进程中起着重要作用。miRNA-22是一种肿瘤抑制因子, 在多种肿瘤中出现异常表达, 并影响肿瘤进程。miRNA-22在肺癌组织中表达量明显低于正常组织, 其过表达能明显抑制肺癌细胞的增殖和侵袭[6]。miRNA-22在肝癌中也表现为表达下调, 并且miRNA-22低表达与肝癌患者的低存活率正相关[7]。然而, miRNA-22在食管癌中的表达和功能方面的研究很少, 与ESCC放射敏感性的关系还不明确。
本研究中, 我们通过体外细胞模型去探究miRNA -22与ESCC放射敏感性的关系。通过建立不同miRNA-22表达的稳定转染细胞模型, 探究miRNA -22表达与ESCC细胞放射敏感性的关系。克隆形成实验和MTT法结果表明, miRNA-22表达水平升高会促进ESCC细胞的放射敏感性。反之, miRNA- 22表达水平降低会抑制ESCC细胞放射敏感性。miRNA-22可以通过调控多个靶基因的表达, 进而调节多个信号通路。在结肠癌中, miRNA-22可以通过抑制TIAM1(T-cell lymphoma invasion and metastasis 1)的表达从而抑制结肠癌细胞的迁移和侵袭[8]。然而, miRNA-22对ESCC放射敏感性的调节机制并不明确, 还有待进一步的研究。
综上所述, 本研究结果表明, miRNA-22表达水平升高会促进ESCC的放射敏感性, 为食管癌的临床放射治疗提供了理论依据。miRNA-22是潜在的ESCC放射敏感性的调节靶点, 有待深入研究其调节作用的分子机制, 将提供更多的临床应用价值。
| [1] |
Jemal A, Siegel R, Ward E, et al. Cancer statistics[J]. CA Cancer J Clin, 2008, 58(2): 71-96. DOI:10.3322/CA.2007.0010 |
| [2] |
Berger B, Belka C. Evidence-based radiation oncology:oesophagus[J]. Radiother Oncol, 2009, 92(2): 276-290. DOI:10.1016/j.radonc.2009.02.019 |
| [3] |
Chaudhry MA, Kreger B, Omaruddin RA. Transcriptional modulation of micro-RNA in human cells differing in radiation sensitivity[J]. Int J Radiat Biol, 2010, 86(7): 569-583. DOI:10.3109/09553001003734568 |
| [4] |
Miranda KC, Huynh T, Tay Y, et al. A pattern-based method for the identification of MicroRNA binding sites and their corresponding heteroduplexes[J]. Cell, 2006, 126(6): 1203-1217. DOI:10.1016/j.cell.2006.07.031 |
| [5] |
Calin GA, Croce CM. MicroRNA signatures in human cancers[J]. Nature Reviews Cancer, 2006, 6(11): 857-866. DOI:10.1038/nrc1997 |
| [6] |
Ling B, Wang GX, Long G, et al. Tumor suppressor miR-22 suppresses lung cancer cell progression through posttranscriptional regulation of ErbB3[J]. J Cancer Res Clin Oncol, 2012, 138(8): 1355-1361. DOI:10.1007/s00432-012-1194-2 |
| [7] |
Zhang J, Yang Y, Yang T, et al. microRNA-22, downregulated in hepatocellular carcinoma and correlated with prognosis, suppresses cell proliferation and tumourigenicity[J]. Br J Cancer, 2010, 103(8): 1215-1220. DOI:10.1038/sj.bjc.6605895 |
| [8] |
Li B, Song Y, Liu TJ, et al. miRNA-22 suppresses colon cancer cell migration and invasion by inbiting the expression of T-cell lymphoma invasion and metastasis 1 and matrix metalloproteinases 2 and 9[J]. Oncol Rep, 2013, 29(5): 1932-1938. DOI:10.3892/or.2013.2300 |