2. 济南大学山东省医学科学院医学与生命科学学院;
3. 山东省肿瘤医院
2. School of Medicine and Life Sciences, University of Jinan-Shandong SDAMS;
3. Shandong Cancer Hospital, SDAMS
恶性胶质瘤是最常见的原发颅内恶性肿瘤, 其发病率占全部脑恶性肿瘤的40~50%[1]。2013版美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南推荐的初始标准治疗方法为最大安全切缘的手术切除、放疗+替莫唑胺同步治疗及替莫唑胺辅助化疗。即使经上述标准治疗, 胶质母细胞瘤(Glioblastoma, GBM)预后仍极差, 中位生存时间仅为9.4~19个月[2]。经放化疗后, 20%~30%的GBM患者可能出现短暂的影像学进展, 特别是在MRI上显示增强范围较前增大, 但大多数患者临床症状不明显, 这种影像学上的"进展"即使不经过治疗在数月后也会消失, 称为"假性进展(Pseudoprogression) " [3]。增强MR是目前诊断及随访GBM的常规影像方法, 但其对放射性脑损伤和肿瘤复发的鉴别诊断具有很大的困难。而"假性进展"和肿瘤的真正进展在治疗方式上截然不同, 准确的鉴别诊断对GBM的临床治疗有重要意义。
本研究通过对疑为复发的脑恶性胶质瘤患者进行MR氢质子波谱分析, 并对患者进行随访, 以手术病理或增强MR随访作为诊断的金标准, 探讨MR氢质子波谱分析对鉴别治疗后脑恶性胶质瘤"假性进展"的价值。
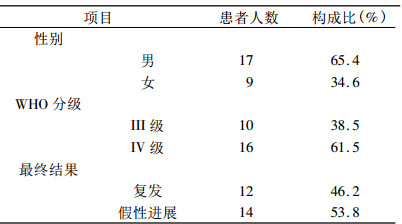
1 材料与方法 1.1 病人资料收集自2010年10月1日至2013年6月30日间就诊于山东省肿瘤医院的治疗后脑恶性胶质瘤患者26例:男性17例, 女性9例, 平均年龄(48.75 ± 12.66)岁, 年龄范围20~68岁, 中位年龄51.5岁。WHO分级: Ⅲ级10例, Ⅳ级16例。纳入标准包括:病理证实为脑恶性胶质瘤; 已行外科手术和/或放射治疗, 经过或/不经过化疗; 临床疑为复发(有脑水肿症状或增强MR提示可疑复发)。排除标准:其他恶性肿瘤导致的脑转移; 非脑胶质瘤的原发性脑肿瘤。所有纳入患者在行增强MR检查时同时进行MR氢质子波谱分析。所有纳入患者均经山东省肿瘤医院医学伦理委员会批准, 并已签署知情同意书。
1.2 Gd-增强MR显像和MR氢质子波谱分析磁共振为荷兰Philips公司生产的Achieva 3.0Tx超导型MR扫描仪, 梯度场强为40 mT/m和80 mT/s, 切换率为200 mT/m/ms和100 mT/m/ms, 采用8通道头颅正交线圈, 常规平扫横轴位T1WI (TR250/TE2.3 ms)、T2WI(TR2105/TE80 ms)、T2WI-FLAIR (TR11000/ TE120 ms、TI2800 ms), 增强后行T1WI横轴位(TR250/TE 2.3 ms)、矢状位(TR250/TE2.3 ms)、冠状位(TR250/TE2.3 ms)扫描。对比剂为广东康臣公司生产的钆喷酸葡胺注射液, 剂量0.1 mmol/kg(0.2 ml/kg), 采用Invivo公司生产的高压注射器, 经肘静脉快速注射, 注射速率2 ml/s。其中NSA = 2, FOV = 23.0 cm × 23.0 cm; 横轴位层厚为6.0 mm, 层间隔1.0 mm; 矢状位层厚为4.0 mm, 层间隔1.0 mm; 冠状位层厚为5.0 mm, 层间隔为1.0 mm。矩阵256 × 256。DWI采用b值= 1 000 s/mm2, TR1 965 ms, TE48 ms。多体素1H-MRS扫描采用点解析波谱序列(2D-PRESS法) : TR2 000 ms, TE144 ms, FOV23.0 cm × 23.0 cm, 层厚10 mm, 激励次数1次, 扫描时间5 min52 s。MRS成像范围尽可能大地包括层面内肿瘤及部分正常组织, 但避开头皮及颅骨等组织, 体素大小: 1.5 cm × 1.5 cm × 1.5 cm, 病例组体素选择瘤体强化区, 体素放置尽量避开脑室、脑池、囊变及大的血管等, 对照组体素均放置于一侧脑白质内。体素内匀场、水抑制扫描均由自动预扫描程序完成。将上述扫描所采集的原始数据传输到独立工作站进行处理, 获得Cho、Cr、NAA值, 并计算Cho/Cr、Cho/NAA、NAA/Cr的比值。
1.3 图像分析及诊断标准所有MR图像由两位20年颅脑MR诊断的高年资放射科医师独立诊断。以手术或活检病理为金标准, 在不能获得病理的患者, 以临床随访结果(通常为Gd-增强MR显像随访)作为诊断标准。
1.4 统计分析统计分析应用SPSS 17.0统计软件完成。根据诊断金标准, 分别计算增强MR和波谱分析的诊断灵敏度(sensitivity)、特异性(specificity)、准确性(accuracy)、阳性预测值(positive predictive value, PPV)和阴性预测值(negative predictive value, NPV), 计量数据用均数±标准差表示, 组间比较采用t检验, P < 0.05表示有统计学意义。
2 结果 2.1 脑恶性胶质瘤患者最终诊断结果根据诊断金标准, 26例患者中共有12例诊断为肿瘤复发, 肿瘤复发率为46.2% (12/26)。患者的基本信息、影像学诊断结果及最终诊断结果见表 1所示。
|
|
表 1 入组患者的基本信息 |
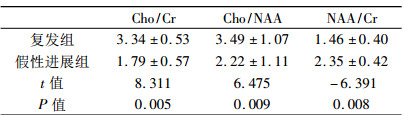
根据最终金标准, 将MRS结果分为复发组和假性进展组, 分别计算两组间的Cho/ Cr、Cho/NAA和NAA/Cr比值, 结果如表 2所示, 两组间三种比值均具有统计学差异(P < 0.01)。以Cho/Cr = 2.5为截断值, MRS诊断真性复发的灵敏度为100%, 特异性为92.9%, 准确性为96.2%。以Cho/ NAA = 3.42为截断值, MRS诊断真性复发的灵敏度为66.7%, 特异性为92.9%。NAA/Cr比值在假性进展组高于复发组, 以1.97为截断值, MRS诊断真性复发的灵敏度为92.9%, 特异性为100%。
|
|
表 2 复发组和假性进展组MRS结果 |
尽管当前脑恶性胶质瘤的治疗进展使患者的中位生存期有了明显提高, 但放疗+替莫唑胺的综合治疗也增加了放疗后损伤的发生率[4]。假性进展被认为是一种对放化疗的治疗反应, 并非真的肿瘤进展或复发。据报道, 单纯放疗所致假性进展的发生率约10%, 而加入替莫唑胺同步化疗后, 其发生率增加了3倍[5]。通常, 假性进展应用常规平扫及增强MRI均难以与肿瘤复发进行鉴别。
磁共振波谱分析(MRS)通过定量检测组织内生化物质的含量, 可以反映局部代谢状况。临床上最常用的是氢质子波谱分析(1H-MRS), 常用于检测的代谢产物包括N-乙酰天门冬氨酸(NAA)、肌酸(Cr)、胆碱(Cho)、磷酸肌酸(PCr)、脂质(Lip)、乳酸(Lae)等。Zeng等[6]对治疗后的脑胶质瘤进行波谱分析, 发现在复发肿瘤的Cho/NAA值和Cho/Cr值均显著高于放射性脑坏死。研究认为, 脑肿瘤复发时, 由于细胞膜合成活跃, Cho、Cr浓度及峰值常呈中度升高, 其中以Cho的升高更为明显, 而NAA水平下降。相反, 在发生放射性脑坏死时, 由于细胞结构崩解, Cho、Cr和NAA水平均发生下降, 典型的坏死可以发生三种物质波峰均下降的MRS征象。本研究发现, 脑胶质瘤复发时, Cho/Cr值和Cho/NAA值明显高于假性进展, 但NAA/Cr值低于假性进展。出现这种现象的原因, 可能是因为Cho在胶质瘤复发时出现了明显升高, 而NAA出现了下降所致。而假性进展时, 出现了Cho值的明显下降。这与Lichy等应用波谱分析观测胶质瘤化疗效果的发现类似[7]。
已有多项研究认为, Cho/Cr比值和Cho/NAA比值对诊断脑胶质瘤复发有意义。Elias等[8]研究认为Cho/NAA值大于1.2时, 敏感度为86%, 特异度为90%。Ando等[9]研究认为Cho/Cr值为1.5时, 诊断胶质瘤复发的敏感度为64%, 特异度为83%; Cho/Cr值为2时, 诊断胶质瘤复发的敏感度为87%, 特异度为89%。在本研究中, 以Cho/Cr = 2.5为截断值, MRS诊断真性复发的灵敏度为100%, 特异性为92.9%, 准确性为96.2%, 而NAA/Cr比值在假性进展组高于复发组, 以1.97为截断值, MRS诊断真性复发的灵敏度为92.9%, 特异性为100%。本研究最佳诊断的截断值与其他研究不同, 考虑主要是因为在治疗后的脑胶质瘤, 通常肿瘤复发、放射性脑损伤和水肿并存, 应用感兴趣区勾画时, 个体间差异较大。
总之, 本研究进一步证实MRS可以应用于脑恶性胶质瘤治疗后复发与假性进展的鉴别, 但具体的感兴趣区的勾画, 界值的确定, 还需要进一步的深入研究。
| [1] |
Ostrom QT, Gittleman H, Farah P, et al. CBTRUS statistical report: Primary brain and central nervous system tumors diagnosed in the United States in 2006-2010[J]. Neuro Oncol, 2013, 15(Suppl 2): ii1-56. |
| [2] |
Yang LJ, Zhou CF, Lin ZX. Temozolomide and Radiotherapy for Newly Diagnosed Glioblastoma Multiforme: A Systematic Review[J]. Cancer Invest, 2014, 32(2): 31-36. DOI:10.3109/07357907.2013.861474 |
| [3] |
Ahluwalia MS, Wen PY. Antiangiogenic therapy for patients with glioblastoma: current challenges in imaging and future directions[J]. Expert Rev Anticancer Ther, 2011, 11(5): 653-656. DOI:10.1586/era.11.35 |
| [4] |
Brandsma D, Van den Bent MJ. Pseudoprogression and pseudoresponse in the treatment of gliomas[J]. Curr Opin Neurol, 2009, 22(6): 633-638. DOI:10.1097/WCO.0b013e328332363e |
| [5] |
Chamberlain MC, Glantz MJ, Chalmers L, et al. Early necrosis following concurrent Temodar and radiotherapy in patients with glioblastoma[J]. J Neurooncol, 2007, 82(1): 81-83. DOI:10.1007/s11060-006-9241-y |
| [6] |
Zeng QS, Li CF, Zhang K, et al. Multivoxel 3D proton MR spectroscopy in the distinction of recurrent glioma from radiation injury[J]. J Neurooncol, 2007, 84(1): 63-69. DOI:10.1007/s11060-007-9341-3 |
| [7] |
Lichy MP, Bachert P, Henze M, et al. Monitoring individual response to brain-tumour chemotherapy: proton MR spectroscopy in a patient with recurrent glioma after stereotactic radiotherapy[J]. Neuroradiology, 2004, 46(2): 126-129. DOI:10.1007/s00234-003-1116-8 |
| [8] |
Elias AE, Carlos RC, Smith EA, et al. MR spectroscopy using normalized and non-normalized metabolite ratios for differentiating recurrent brain tumor from radiation injury[J]. Acad Radiol, 2011, 18(9): 1101-1108. DOI:10.1016/j.acra.2011.05.006 |
| [9] |
Ando K, Ishikura R, Nagami Y, et al. Usefulness of Cho/Cr ratio in proton MR spectroscopy for differentiating residual/recurrent glioma from non-neoplastic lesions[J]. Nihon Igaku Hoshasen Gakkai zasshi, Nippon acta radiologica, 2004, 64(3): 121-126. |