2. 中国医学科学院北京协和医学院放射医学研究所
2. Institute of Radiation Medicine, Chinese Academy of Medical Sciences & Peking Union Medical College
恶性肿瘤是当前威胁人类生命的主要疾病, 放射治疗是肿瘤治疗的重要手段[1]。然而放射治疗在杀伤肿瘤细胞的同时不可避免的会损伤到正常组织, 体部照射尤其是胸部放疗常会损伤到心、肝和肺等重要脏器组织。放射治疗产生的氧自由基其原发反应及继发反应导致副作用增大, 往往使得病人被迫中断治疗甚至危及生命。检测机体超氧化物歧化酶(SOD)活性和丙二醛(MDA)的含量可以间接反应机体自由基水平高低, 从而衡量脏器放射损伤的情况[2]。角质细胞生长因子(keratinocyte growth factor, KGF)是成纤维生长因子家族的第7位成员, 可以特异性结合上皮细胞特殊受体, 参与放射损伤的修复及免疫重建[3]。近年来对角质细胞生长因子的研究逐渐增多, 而本文旨在通过对受照射小鼠的心、肝、肺等器官抗氧化实验结果的对比观察, 探讨KGF以及KGF联合G-CSF对放射损伤的保护作用。
1 材料与方法 1.1 实验动物无特定病原体(SPF)级C57BL/6小鼠共70只, 6~8周龄, 雌雄各半, 体重(20 ± 2) g, 军事医学院实验动物中心提供[合格证号:SCXK (军)2007 -004]。饲养环境为中国医学科学院放射医学研究所实验动物房(SPF级)。
1.2 试剂与仪器重组人粒细胞集落刺激因子注射液(rhG-CSF)(杭州九源基因工程有限公司); rmKGF (以色列PROSPEC公司); 考马斯亮兰蛋白测定试剂盒、总超氧化物歧化酶(T-SOD)试剂盒和丙二醛(MDA)测定试剂盒(南京建成生物工程研究所)。137Cs -γ射线照射源(Gammacel 40, 加拿大); 电子精密天平(METTLER TOLEDO, 美国)。
1.3 实验分组及方法70只小鼠按体重随机分成五组, 分别为:空白对照组、单纯照射组、KGF给药组、G -CSF给药组、KGF-G-CSF联合给药组, 每组14只, 雌雄各半。受试小鼠接受137 Cs-γ射线一次性全身照射, 剂量为5.0 Gy, 剂量率0.7125 Gy/min, 各组均在照射后立即腹腔注射给药, 空白对照组和单纯照射组给予生理盐水0.2 ml/只/d, 连续给药8 d, KGF组给予rmKGF 250μg/kg、0.2 ml/只/d, 连续给药2 d, G-CSF组给予rhG-CSF 450 μg/kg、0.2 ml/只/d, 连续给药8 d, KGF+G-CSF组同时给予rmKGF (250 μg/kg、0.2 ml/只/d, 连续给药2 d)和rhG-CSF (450 μg/kg、0.2 ml/只/d, 连续给药8 d)。
1.4 检测指标 1.4.1 体重分别取照射当天(照射前)、照射后第1、3、5、8天(处死前)5个时间点, 对各组小鼠称重观察体重变化。
1.4.2 脏器指数照射后第8天, 小鼠眼球取血后用颈椎脱臼法处死, 解剖取出脏器组织, 称取湿重, 按下列公式计算脏器指数并观察:脏器指数=脏器重量(mg)/体重(g)。
1.4.3 心肝肺SOD活性、MDA含量检测摘取小鼠心、肝、肺, 研磨组织按考马斯亮兰、SOD、MDA试剂盒说明用比色法进行检测。
1.5 统计学处理采用SPSS 19.0软件对数据进行统计学处理, 数据用x±s表示, 多组比较采用单因素ANOVA方差分析, 组间两两比较采用LDS法, P < 0.05为差异有统计学意义。
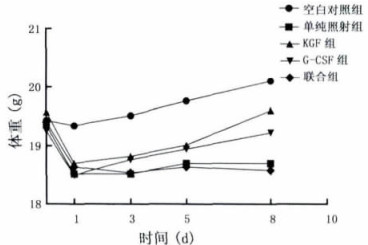
2 结果 2.1 空白对照组、单纯照射组、KGF组、G-CSF组和联合组小鼠体重的变化在小鼠生长方面, 正常组表现活跃, 而其余四组均出现了活动性差、饮食饮水量下降、皮毛不整齐并光泽性差等情况。在照射前、照射后第1、3、5、8天称重, 受放射影响, 小鼠的重量变化趋势如图 1。正常组的小鼠体重平稳增加。照射后第1天, 受照各组均出现体重下降, 其中单纯照射组与联合组体重持续较低, KGF组和GSF组在第1天下降到最低点后上升较明显。
|
图 1 137Cs-γ射线照射后小鼠的体重变化 |
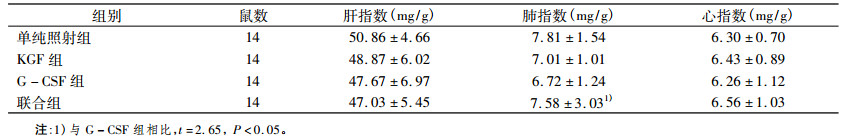
照射后, 单纯照射组、KGF组、G-CSF组和联合组小鼠脏器指数都降低, 其中, 与G-CSF组相比, 联合组的肺指数差异有统计学意义(t=2.65, P < 0.05);但是其余各给药组小鼠的肝指数、肺指数和心指数影响没有发生明显的变化, 其差异没有统计学意义, 见表 1。
|
|
表 1 137Cs-γ照射后各组小鼠脏器指数(x±s) |
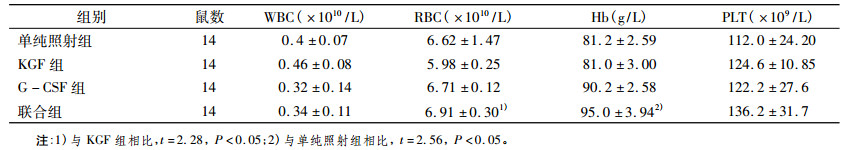
照射后各组小鼠造血系统受到了严重的影响, 给药组小鼠的造血系统表现了一定程度的修复。联合组与KGF组相比, 能够提高外周血中Hb含量, 具有统计学意义(t=2.56, P < 0.05);能够提高RBC, 具有统计学意义(t=2.28, P < 0.05), 见表 2。
|
|
表 2 137Cs-γ照射后各组小鼠外周血WBC、RBC、Hb、PLT的含量(x±s) |
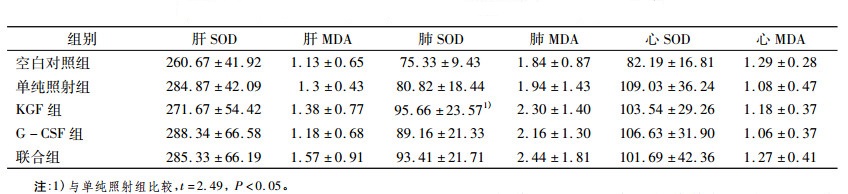
KGF组与单纯照射组比较, 肺SOD活性(t=2.49, P < 0.05)含量有显著的提高; 从整体的实验数据看, 联合组小鼠各指标与G-CSF和KGF组比没有明显的优势:肝SOD活性方面, 联合组和KGF组数据并没有明显的差异; 肺SOD活性方面, 联合组比KGF组稍微偏高, 两者的数据没有统计学意义; 心SOD活性方面, G-CSF组比联合组的稍微偏高, 两者的数据没有统计学意义。该部分数据显示, G-CSF组肝、心的SOD活性高于KGF组和联合组; KGF组的肺SOD活性高于G-CSF组和KGF-G-CSF组, 见表 3。
|
|
表 3 照射后各组小鼠肝、肺、心的SOD活性及MDA含量(x±s) |
近年来, 肿瘤放射治疗过程中对正常组织的损伤已经成为研究的热点。放射治疗的同时, 正常组织受到了严重的影响, 如有丝分裂细胞死亡, 不断激活各种细胞因子的级联系统导致血管损伤, 组织缺氧, 大量的细胞外基质降解等[4], 放射防护剂可以中断和干预这些过程的发生, 减缓组织的损伤[5]。如何降低放射治疗对正常组织的损伤, 获得更佳的治疗效果, 已经成为医学工作者的重要研究内容。放射损伤防护剂的研究中生长因子是研究最多的, 但KGF及它和其它生长因子联合作用的研究并不多。
放射性肺损伤经常出现在胸部肿瘤放疗后, 导致肺部发生急性渗出, 还会出现炎性细胞浸润, 甚至伴随肺泡崩溃, 形成胶原纤维等, 导致放射性肺炎和放射性肺纤维化的产生[6]。本实验中KGF于肺部的抗氧化能力比其他给药组更有效, 这可能与KGF参与的细胞活动有关。有研究表明KGF可以减轻或预防肺损伤, 能够减少胶原纤维的聚集, 预防氧化物、过氧化物的损伤, 在肺的发育和损伤修复起着重要的作用[7]。无论在体内还是在体外, KGF都对肺泡上皮细胞的增殖有促进作用, 并且对其愈合起着积极作用, 这可能是KGF影响了相关酶活性及某些基因的表达。KGF能够提高肺上皮细胞主动运输离子的作用, 通过提高钠泵的数量, 提高肺上皮细胞Na+、K+-ATPase mRNA的表达等实现, 利于损伤后肺积水的排出, 并预防过氧化物诱导的急性肺损伤, 其原因是KGF对保持上皮屏障的完整性有重要的作用[8]。KGF能够维持上皮细胞间连接的作用, 当用KGF对人支气管上皮单层细胞进行处理时, 可防止过氧化物带来的渗透增强。KGF通过增强DNA修复进行对过氧化物所致肺上皮损伤的防护作用, 并能够增强上皮细胞DNA聚合酶对受损的上皮细胞DNA的修复作用[9]。KGF能够对皮肤、肺、膀胱、肾等由于放射治疗所致损伤进行修复, 在细胞分化、增殖、DNA修复和放射所致氧化损伤方面起着关键性的作用[10]。因此, KGF也被认为是放射防护剂中作为刺激黏膜修复的有应用前景的重要因子[11]。
以往认为心脏属于放射不敏感器官, 对射线具有较强的抵抗力和耐受性, 但是近年的临床实践证明其抗辐射能力并非如此, 胸部放疗所致心脏损伤已成为关注的焦点[12]。《新英格兰医学杂志》报道了一个典型案例, 一位于40年前接受放疗治疗霍奇金淋巴瘤的56岁女性突发呼吸困难和休克入院5 h后死亡, 尸检报告显示患者有冠状动脉粥样硬化导致的急性心肌梗死合并二尖瓣、主动脉病变等, 均为放射性损伤所致[13]。如何尽可能降低放化疗过程中所致心脏毒性损伤是肿瘤医师的重要研究项目。本实验中, G- CSF组比其它给药组对于肝脏和心脏的修复能力更有效, 有研究发现G-CSF可以减缓或抑制心肌细胞的死亡, 这可能与其参与心肌细胞的信号通路有关[14]。心肌细胞表面具有G-CSF受体, 当其受体被激活, G-CSF可以与其结合, 激活相关的信号通路-激活相关的蛋白激酶Jak2-STAT3和Akt-eNOS信号转导途径, 抑制心肌细胞凋亡, 这表明G-CSF对心肌细胞具有抗凋亡效应[15]。
关于放疗对造血和免疫系统方面的影响, 受照小鼠骨髓涂片发现单核细胞呈肾形、淋巴细胞核椭圆形、骨髓增生不良等。急性辐射对小鼠胸腺细胞的增殖、分化有严重的影响, 明显降低胸腺输出功能[16]。有研究表明:KGF对胸腺生成素的形成有促进作用, 诱导胸腺上皮细胞增殖, 重组皮质, 使免疫功能重建, 促进小鼠体重回复[17]。G-CFS可将骨髓干祖细胞动员至外周血中, 对淋巴干祖细胞归巢到胸腺起到促进作用, 进而促进胸腺功能的恢复[17]。本实验结果表明不同给药组对放射损伤小鼠造血系统均有保护作用, 尤以联合组效果最佳。这可能与KGF和G- CSF共同参与的细胞活动相关, KGF和G-CSF能直接作用于骨髓造血祖细胞, 对其增殖、分化和成熟有积极作用, 而KGF是造血微环境中的组成成分, 二者对造血过程的不同过程进行调节, 对造血系统的恢复具有协同作用[18]。
放射防护剂能够减少放射治疗所致机体损伤, 在临床上有着广泛的应用前景。本文通过研究KGF、G -CSF对受照小鼠的放射损伤修复作用, 旨在为放射治疗所致正常组织损伤的临床救治探索一种新思路, 为能提高癌症患者放疗后的生活质量提供助力。
| [1] |
殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学[M]. 4版. 北京: 中国协和医科大学出版社, 2008: 1-3.
|
| [2] |
赵航, 贺中民, 徐宏海, 等. 小鼠低剂量辐射损伤模型的初步研究[J]. 现代生物医学进展, 2012(20): 3817-3821. |
| [3] |
Auf DU, Krampert M, Kumin A, et al. Keratinocyte growth factor:effects on keratinocytes and mechanisms of action[J]. Eur J Cell Biol, 2004, 83(11-12): 607-612. DOI:10.1078/0171-9335-00389 |
| [4] |
Bentzen SM. Preventing or reducing late side effects of radiation therapy:radiobiology meets molecular pathology[J]. Nat Rev Cancer, 2006, 6(9): 702-713. DOI:10.1038/nrc1950 |
| [5] |
Citrin D, Cotrim AP, Hyodo F, et al. Radioprotectors and mitigators of radiation-induced normal tissue injury[J]. Oncologist, 2010, 15(4): 360-371. DOI:10.1634/theoncologist.2009-S104 |
| [6] |
Kursova LV, Konoplyannikov AG, Pasov VV, et al. Possibilities for the use of autologous mesenchymal stem cells in the therapy of radiation-induced lung injuries[J]. Bull Exp Biol Med, 2009, 147(4): 542-546. DOI:10.1007/s10517-009-0538-7 |
| [7] |
Jenkins P, Watts J. An improved model for predicting radiation pneumonitis incorporating clinical and dosimetric variables[J]. Int J Radiat Oncol Biol Phys, 2011, 80(4): 1023-1029. DOI:10.1016/j.ijrobp.2010.03.058 |
| [8] |
Sakamoto S, Yazawa T, Baba Y, et al. Keratinocyte growth factor gene transduction ameliorates pulmonary fibrosis induced by bleomycin in mice[J]. Am J Respir Cell Mol Biol, 2011, 45(3): 489-497. |
| [9] |
宗宪磊, 蔡景龙, 姜笃银, 等. 角质细胞生长因子研究进展[J]. 中国修复重建外科杂志, 2009(02): 188-193. |
| [10] |
Liu CJ, Jin JD, Lv TD, et al. Keratinocyte growth factor gene therapy ameliorates ulcerative colitis in rats[J]. World J Gastroenterol, 2011, 17(21): 2632-2640. DOI:10.3748/wjg.v17.i21.2632 |
| [11] |
Lombaert IM, Brunsting JF, Wierenga PK, et al. Keratinocyte growth factor prevents radiation damage to salivary glands by expansion of the stem/progenitor pool[J]. Stem Cells, 2008, 26(10): 2595-2601. DOI:10.1634/stemcells.2007-1034 |
| [12] |
武霞, 王宇, 汪延明. 胸部肿瘤放射治疗对心脏损伤的研究进展[J]. 实用医药杂志, 2011(05): 470-473. DOI:10.3969/j.issn.1671-4008.2011.05.061 |
| [13] |
Klempner MS, Talbot EA, Lee SI, et al. Case records of the Massachusetts General Hospital.Case 25-2010.A 24-year-old woman with abdominal pain and shock[J]. N Engl J Med, 2010, 363(8): 766-777. DOI:10.1056/NEJMcpc1003887 |
| [14] |
Adachi Y, Imagawa J, Suzuki Y, et al. G-CSF treatment increases side population cell infiltration after myocardial infarction in mice[J]. J Mol Cell Cardiol, 2004, 36(5): 707-710. DOI:10.1016/j.yjmcc.2004.03.005 |
| [15] |
Bertho JM, Frick J, Prat M, et al. Comparison of autologous cell therapy and granulocyte-colony stimulating factor (G-CSF) injection vs.G-CSF injection alone for the treatment of acute radiation syndrome in a non-human primate mode[J]. Int J Radiat Oncol Biol Phys, 2005, 63(3): 911-920. DOI:10.1016/j.ijrobp.2005.03.045 |
| [16] |
赵红霞, 郭梅, 孙雪冬, 等. 粒细胞集落刺激因子对亚致死剂量照射后小鼠胸腺细胞周期及近期输出功能的影响[J]. 中国实验血液学杂志, 2011(05): 1294-1298. |
| [17] |
Wils EJ, Aerts-Kaya FS, Rombouts EJ, et al. Keratinocyte growth factor and stem cell factor to improve thymopoiesis after autologous CD34+cell transplantation in rhesus macaques[J]. Biol Blood Marrow Transplant, 2012, 18(1): 55-65. DOI:10.1016/j.bbmt.2011.09.010 |
| [18] |
Pereira CT, Herndon DN, Rocker R, et al. Liposomal gene transfer of keratinocyte growth factor improves wound healing by altering growth factor and collagen expression[J]. J Surg Res, 2007, 139(2): 222-228. DOI:10.1016/j.jss.2006.09.005 |