2. 一汽总医院放疗科
2. The Separtment of radiotherapy of General Hospital of Faw
乳腺癌是妇女的高发恶性肿瘤, 近年来女性乳腺癌发病率明显增加, 严重危害女性健康[1]。目前I、Ⅱ期乳腺癌的保乳手术加上术后放疗已成为乳腺癌的主要治疗方法, 这种综合治疗方法无论在长期生存率方面还是局控率方面, 其疗效与根治术相同[2]。二切线野加楔形板的常规放疗技术(conventional radiotherapy, CRT)为乳腺癌术后放疗的传统治疗方法, 由于CRT剂量分布不均匀, 周围正常组织受照剂量较高, 使得患者的治疗效果及长期生存受到影响。新兴的三维适形调强放疗(intensity modulated radiotherapy, IMRT)能够改善靶区剂量均匀性, 同时减少周围危及器官的照射, 国外一些文献报道IMRT在乳腺癌放疗中具有一定的治疗优势[3]。因此本文通过研究常规放疗与动态调强放疗的的剂量学差异, 为IMRT在乳腺癌保乳术后的临床应用提供理论依据。
1 材料与方法 1.1 临床资料选取2012年5月至2013年8月期间吉林大学第二医院放疗科收治的临床分期为T1N0M0的12例女性乳腺癌保乳术后患者, 发病年龄38 ~ 59岁, 中位年龄47岁, 其中左侧乳腺癌患者5例, 右侧乳腺癌患者7例。所有患者术后病理证实为乳腺癌, 且术后无残留; 其中浸润性导管癌8例, 导管内癌1例, 髓样癌1例。
1.2 定位方法患者仰卧于乳腺癌专用放疗托架上, 患侧上肢上举固定, 头向健侧偏转或正卧。在激光灯下用铅丝标记体中线、腋中线, 于胸骨切迹处行上界标记, 于乳房皱褶下2 cm处行下界标记。在Philips大孔径16排放疗专用CT定位机下进行CT扫描, 嘱患者平静呼吸, 扫描范围上至下颌骨, 下至下界标记下2 cm, 扫描层厚为5 mm。扫描后将图像传至三维治疗计划系统。
1.3 靶区勾画临床靶区(clinical tumor volume, CTV):包括患侧乳腺、胸大肌筋膜, 不包括皮肤、胸大小肌、肋骨和肋间肌。CTV前界为皮肤下0.5 cm, 后界为紧贴胸壁, 内界为体中线, 外界为腋中线。计划靶区(plan tumor volume, PTV): CTV外放得到, 头脚方向、左右(胸骨、腋窝)方向各放0.7 cm, 胸壁内侧(向肺方向)放0.5 cm, 但不包括肺, 皮肤方向不外放。危及器官(organs at risks, OARs):包括双肺、心脏轮廓。在勾面轮廓时, 注意轮廓的平滑度和相邻层面的连续性, 勾画完毕后从三维方向观视轮廓体积并进行必要修整。
1.4 计划设计 1.4.1 CRT计划采用常规切线野加楔形板照射技术, 在TPS系统中依据体表标记及靶区确定射野中心及两切线野入射角度。调整内、外切线野入射角度, 使PTV在射野方向观上投射最小, 切线野上下界按PTV上下方向各扩大1 cm, 外界在乳头外放1.5 ~ 2 cm, 后界要尽量确保在包括PTV的同时切肺的厚度在1.5 ~ 2 cm以内。为使射野中心层面的剂量分布尽量均匀, 添加适当的楔形板。
1.4.2 IMRT计划采用简化动态调强放疗(sIMRT)技术, 总共设置四野: 2个照射野设置与常规内、外切线野相同, 与内、外切线野间隔15°再各设一照射野; 分别设置计划靶区和正常组织剂量体积限制条件, 设定野内最大剂量 < 105%处方剂量, 计划95%的乳房体积接受的处方剂量不小于95%;患侧肺V20 < 25%, 平均剂量 < 15 Gy; 对于左侧患者, 心脏V50< 50%。
针对所有患者分别设计两种计划, 处方剂量为:总剂量50 Gy/25次, 1次/d, 5次/周。
1.5 评价指标比较两种计划的PTV、OARs的剂量体积直方图(dose volume histogram, DVH)等物理参数的差别; 对PTV、OARs的受照剂量进行分析如下。
1.5.1 PTV的体积参数95%、105%和110%的处方剂量等剂量曲线包绕PTV的体积V95%、V105%、V110%。
1.5.2 PTV剂量适形度指数(CI, conformity index)[4]
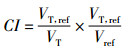
|
其中, VT, ref为参考等剂量线(95%)所覆盖的所有PTV体积; VT为PTV体积; Vref为参考等剂量线(95%)所包围的所有体积, CI值为0 ~ l, CI值越大, 表示适形度越好, 等于1时最理想, 等于0时最差。
1.5.3 PTV剂量均匀性指数(HI, homogeneity index)[5]
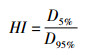
|
HI值越低(即越接近1), 表示靶区剂量均匀性越好。
1.5.4 OARs受量患侧肺接受30 Gy、20 Gy的体积V30、V20和肺平均剂量(mean lung dose, MLD)及左侧乳腺癌患者心脏接受50 Gy、40 Gy、30 Gy的体积V50、V40、V30。
1.6 统计学分析采用采用SPSS19.0统计软件。计量资料用x ± s表示, 组间比较采用两样本t检验。P < 0.05为差异有统计学意义。
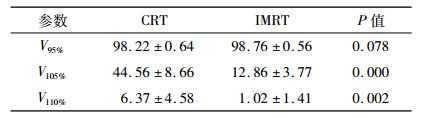
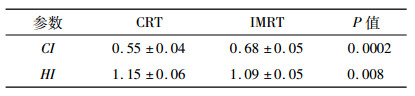
2 结果 2.1 两种计划靶区的剂量学比较两种计划中95%等剂量曲线均能很好的覆盖PTV(P < 0.05), 而IMRT计划的V105%、V110%分别为12.86%和1.02%均明显低于CRT计划的44.56%和6.37% (表 1, P < 0.05), 说明IMRT明显减少了高剂量区的照射。同时IMRT计划CI值为0.68高于CRT的0.55, HI值为1.09低于CRT的1.15(表 2, P < 0.05), 进一步说明IMRT的剂量分布更加均匀, 无明显冷点和热点。
|
|
表 1 CRT和IMRT计划靶区V95%、V105%、V110%的比较[(x ± s),%] |
|
|
表 2 CRT和IMRT计划靶区CI与HI的比较[(x ± s),%] |
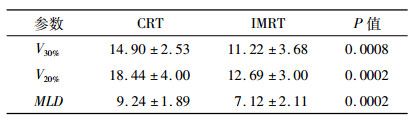
IMRT计划中患侧肺V30、V20较CRT计划分别降低了3.68%、5.75%, MLD较CRT计划降低了2.12 Gy(表 3, P < 0.05), 同时左侧乳腺癌患者中IMRT计划的心脏V50、V40、V30分别为0、1.38%、2.92%, 明显低于CRT计划的1.68%、7.06%、8.91% (表 4, P < 0.05), 此结果说明IMRT相比CRT能很好的降低OARs的受照射剂量, 在治疗的同时更好的保护心、肺等周围正常组织。
|
|
表 3 CRT和IMRT患侧肺受照体积的比较[(x ± s),%] |
|
|
表 4 左侧乳腺癌患者两种计划心脏受照体积比较[(x ± s),%] |
早期乳腺癌保乳术后辅助放射治疗已成为目前标准的治疗手段, 由于患者局控率较好, 长期生存率较高, 因此治疗后远期并发症的发生直接影响患者的生存质量, 术后放疗技术的改进也日益受到人们的关注[6]。本文通过对比分析12例乳腺癌保乳术后患者CRT与IMRT的剂量学差异, 进一步证实IMRT在早期乳腺癌保乳术后放疗中的治疗优势。
传统的术后常规切线野放疗技术, 由于乳腺形状不规则、胸壁曲度及乳腺的厚度变化较大, 使得靶区的剂量分布不均匀, 乳腺的上下部及乳头下方存在高剂量区, 部分剂量高达处方剂量的115% ~ 120%, 甚至更高, 使得患者出现明显的皮肤反应, 直接影响患者治疗后的美容效果[7]。IMRT能够对靶区内各点的输出剂量进行调制, 使靶区的剂量分布更加适形, 从而提高靶区剂量的均匀性。本研究中两种放疗方法95%等剂量曲线均能很好地包绕计划靶区, 而IMRT计划中PTV接受105%及110%处方剂量的体积较CRT计划降低了31.7%和5.35%, 具有统计学意义, 说明IMRT较CRT在保证治疗剂量的同时, 明显减少了高剂量区的照射范围。此外, 本研究中IMRT计划PTV适形指数(CI)平均值为0.68, 高于CRT计划的0.55 (P < 0.05);均匀指数(HI)平均值为1.09低于CRT计划的1.15(P < 0.05), 进一步说明IMRT较CRT靶区的剂量分布更加均匀。Kestin LL等[8]对32例早期乳腺癌调强放疗患者进行临床分析, 结果显示IMRT明显降低了急性皮肤反应的发生率, 并减轻了其反应程度。Harsolia A[9]等对93例接受IMRT和79例接受CRT的乳腺癌术后患者进行了临床观察, 结果显示IMRT较CRT, 急性皮炎、水肿、色素沉着的发生率分别降低了44%、27%、45%。这些临床观察结果与本文剂量学研究结果一致。
常规切线野放疗不可避免的将一定体积的心脏和肺组织包含入照射野, 心、肺受到照射的剂量越高、体积越大, 放射性肺炎发生的程度越重, 心肌损伤越明显[10]。而IMRT通过光栅使得照射野与靶区形状适形, 同时对射线强度进行调节, 可提高乳腺靶区内的剂量, 对心脏和肺组织进行遮挡, 减少心、肺的照射[11]。本研究结果显示IMRT与CRT比较, 肺V30%和V20%分别降低了3.68%和5.75%, 同时MLD降低了2.12 Gy (P < 0.05);左侧乳腺癌患者心脏V30、V40和V50分别降低了5.99%、5.68%和1.68% (P < 0.05)。Hurkmans CW等[12]对17名乳腺癌患者进行回顾性分析结果显示: IMRT与CRT相比, 心脏和肺组织受照剂量减少, 心脏晚期并发症发生概率下降了3.9%, 晚期肺炎发生概率降低了0.2% (P < 0.05), 表明IMRT剂量分布更均匀, 更好地保护了周围正常组织, 本研究通过两种计划靶区剂量学分布也证实了这一结果。
总之, IMRT技术为目前放射治疗的趋势, 已在头颈及前列腺肿瘤等方面得到了广泛的应用。本研究通过物理学角度对比了早期乳腺癌术后IMRT与CRT的剂量学差异, 证实了IM- RT在靶区分布的剂量学优势, 在理论上可得到更好的美容效果及较低的远期并发症。IMRT在早期乳腺癌保乳术后放疗的临床治疗效果, 仍需要大规模的临床观察进一步验证。
| [1] |
刘丽, 丁辉, 潘迎, 等. 北京市妇女病普查中恶性肿瘤的检出状况与趋势[J]. 中国妇幼保健, 2013, 28(22): 3644-3646. DOI:10.7620/zgfybj.j.issn.1001-4411.2013.22.34 |
| [2] |
Veronesi U, Cascinelli N, Mariani L, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer[J]. N Engl J Med, 2002, 347: 1227-1232. DOI:10.1056/NEJMoa020989 |
| [3] |
Saibishkumar EP, MacKenzie MA, Severin D, et al. Skin-sparing radiation using intensity-modulated radiotherapy after conservative surgery in early-stage breast cancer: a planning study[J]. Int J Radiat Oncol Biol Phys, 2008, 70(2): 485-491. DOI:10.1016/j.ijrobp.2007.06.049 |
| [4] |
Feuvret L, Noel G, Mazeron JJ, et al. Conformity index: a review[J]. Int J Radiat Oncol Biol Phys, 2006, 64(2): 333-342. DOI:10.1016/j.ijrobp.2005.09.028 |
| [5] |
Souhami L, Seiferheld W, Brachman D, et al. Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme: report of Radiation Therapy Oncology Group 93-05 protocol[J]. Int J Radiat Oncol Biol Phys, 2004, 60(3): 853-860. DOI:10.1016/j.ijrobp.2004.04.011 |
| [6] |
Zhang F, Zheng M. Dosimetric evaluation of conventional radiotherapy, 3-D conformal radiotherapy and direct machine parameter op timisation intensity-modulated radiotherapy for breast cancer after conservative surgery[J]. J Med Imaging Radiat Oncol, 2011, 55(6): 595-602. DOI:10.1111/jmiro.2011.55.issue-6 |
| [7] |
Buchholz TA, Gurgoze E, Bice WS, et al. Dosimetric analysis of intact breast irradiation in off-axis planes[J]. Int J Radiat Oncol Biol Phys, 1997, 39(1): 261-267. DOI:10.1016/S0360-3016(97)00292-7 |
| [8] |
Kestin LL, Sharpe MB, Frazier RC, et al. Intensity modulation to improve dose uniformity with tangential breast radiotherapy: initial clinical experience[J]. Int J Radiat Oncol Biol Phys, 2000, 48(5): 1559-1568. DOI:10.1016/S0360-3016(00)01396-1 |
| [9] |
Harsolia A, Kestin L, Grills I, et al. Intensity-modulated radiotherapy results in significant decrease in clinical toxicities compared with conventional wedge-based breast radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2007, 68(5): 1375-1380. DOI:10.1016/j.ijrobp.2007.02.044 |
| [10] |
戴晓萍, 郭建萍. 乳腺癌术后放疗病人血清心肌钙蛋白T测定与心脏损伤的研究[J]. 肿瘤学杂志, 2005, 11(4): 292-293. |
| [11] |
David L, Elizabeth J, Adams R, et al. Cardiac avoidance in breast radiotherapy: a comparison of simple shielding techniques with intensity-modulated radio-therapy[J]. Radiotherapy and Oncology, 2001, 60(3): 247-255. DOI:10.1016/S0167-8140(01)00374-7 |
| [12] |
Hurkmans CW, Cho BC, Damen E, et al. Reduction of cardiac and lung complication probabilities after breast irradiation using conformal radiotherapy with or without intensity modulation[J]. Radiother Oncol, 2002, 62(2): 163-171. DOI:10.1016/S0167-8140(01)00473-X |
| [13] |
白雪, 杜向慧, 王升晔, 等. 乳腺癌保乳术后调强计划的剂量学研究[J]. 中国辐射卫生, 2013, 22(2): 242-245. |
| [14] |
Amichetti M, Vidali C. Radiotherapy after conservative surgery in ductal carcinoma in situ of the breast: a review[J]. Int J Surg Oncol, 2012, 635-404. |