由于世界核安全形势和各种放射治疗的需要, 辐射防护药的研究再一次引起人们的关注和重视。目前, 氨巯基化合物仍是辐射防护药物研究的热点, 如半胱胺、胱胺、氨乙基异硫脲和氨基丙胺基乙基硫代磷酸单钠盐(WR-2721)[1-3]。其中WR-2721是防护效果较好的一种防护药, 但临床应用时发现其有一定的毒性[4, 5]。因此, 需要继续探索高效低毒的新型抗放药物, 使之早日应用于临床。
十一氢巯基十二硼化钠(Na2B12 H11 SH), 也称硼卡钠(sodium borocaptate, BSH)。在欧洲和日本, BSH在脑肿瘤的硼中子俘获治疗(boron neutron capture therapy, BNCT)中得到了广泛的临床应用, 近几年也逐渐开始应用于头颈部肿瘤和肝癌的治疗[6-10]。研究表明BSH对低线性能量转换(low LET)辐射具有辐射保护效应, 且临床应用显示BSH对正常组织毒性极小[11-13]。本文检测了腹腔注射BSH的小鼠经60Co γ射线一次性全身照射后机体外周血细胞计数和脏器指数的变化。
1 材料与方法 1.1 实验动物第二军医大学动物实验中心提供Balb/c小鼠, 雄性, 6~8周龄, 体重(20 ± 2) g。生产证号:SCXK (沪)2007-0003, 使用证号:SY (沪)2007 -0003。
1.2 照射条件60Co γ射线(第二军医大学辐照中心)一次性全身照射, 6 Gy, 剂量率为0.8 Gy/min。
1.3 主要试剂与仪器WR-2721由北京军事医学科学院放射医学研究所李鲁老师惠赠; 硼卡钠(BSH)购自捷克斯洛伐克Kat-Chem有限公司。离心机(Beckman Coulter, Allegra 64R Centrifuge); MEK-5216K型血细胞分析仪(Nihon Kohden Coproration)。
1.4 动物分组与给药将小鼠按体重随机分为正常对照组、模型组、阳性药组、BSH低、中、高剂量组, 每组7只。实验组以BSH腹腔注射, 低、中、高剂量分别为20 mg/kg、40 mg/kg、80 mg/kg, 于照射前24 h注射(0.2 ml/20 g), 正常对照组和模型组注射等量生理盐水, WR-2721照前连续2 d腹腔注射200 mg/kg (0.2 ml/20 g)。给药结束后, 模型组和给药组60Co γ射线一次性全身照射, 照射剂量为6 Gy。
1.5 外周血细胞计数于照射后第3天、照射后第14天分别从小鼠内眦静脉丛取血20 μl, 用血细胞计数仪检测红细胞、血红蛋白、白细胞、血小板等。
1.6 脏器指数测定脱臼处死小鼠, 称量体重, 并取肝脏、肾脏、脾、睾丸、附睾及胸腺称重, 计算脏器指数。
1.7 统计分析所有检测结果以x ± s表示。采用SPSS 12.0软件对结果进行t检验统计学处理。
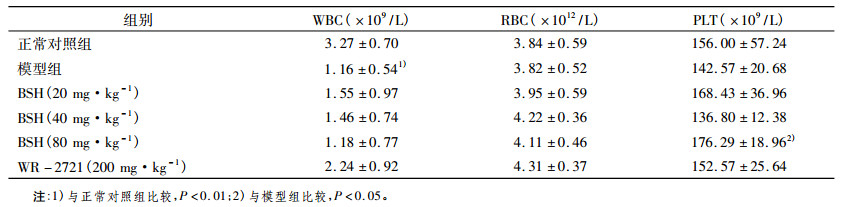
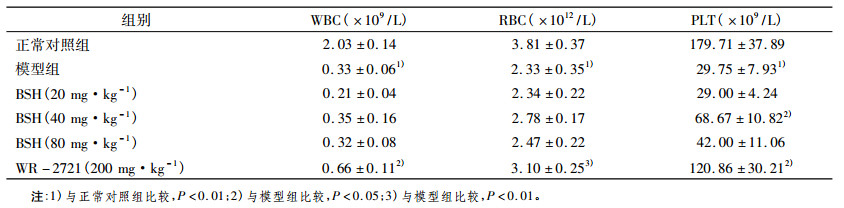
2 结果 2.1 BSH对照射小鼠外周血细胞的影响照射后第3天、第14天, 小鼠外周血血细胞计数结果分别如表 1、表 2所示。照后第3天, 与对照组比较, 模型组白细胞计数显著下降(P < 0.01);与模型组比较, BSH高剂量组血小板计数显著增加(P < 0.05)。照后第14天, 与对照组比较, 模型组白细胞、红细胞和血小板计数均显著下降(P < 0.01);与模型组比较, BSH中剂量组血小板显著升高(P < 0.01)。
|
|
表 1 照射后第3天小鼠外周血细胞数(n = 7,x ± s) |
|
|
表 2 照射后第14天小鼠外周血细胞数(n = 7,x ± s) |
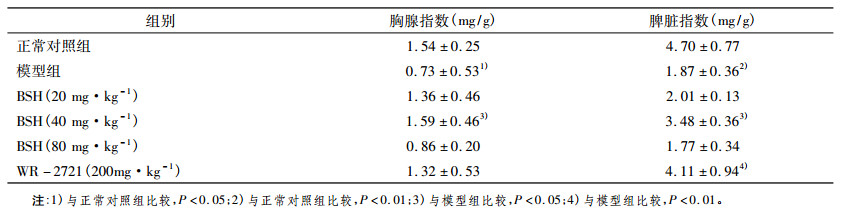
照后第14 d, 各组动物的体重、胸腺指数、脾脏指数见表 3。模型组胸腺和脾脏指数均比对照组下降, 具有统计学意义(P < 0.05, P < 0.01)。与模型组比较, BSH中剂量组胸腺指数、脾脏指数显著升高(P < 0.05)。
|
|
表 3 照射后第14天小鼠胸腺、脾脏指数(n = 7,x ± s) |
辐射作用于机体后, 出现形态变化最早的就是造血系统。造血系统辐射损伤后, 造血功能低下或衰竭, 白细胞、红细胞和血小板数明显减少, 从而诱发感染、贫血、出血等并发症。因此, 造血系统辐射损伤的治疗是放射病治疗的中心环节。胸腺是电离辐射作用的重要靶器官。X射线照射后, 可引起胸腺细胞形态和功能的变化, 随着剂量的增大, 胸腺重量进行性减少[14, 15]。崔玉芳等采用致死剂量γ射线照射小鼠, 结果发现, 6 Gy照射后数小时, 脾脏体积开始缩小[16]。免疫系统的严重受损, 是急性放射病极期发生急性感染和引起免疫功能长期低下的重要原因。寻找有效的辐射免疫损伤防治措施, 也是急性放射病救治重要研究内容之一。
本实验考察了不同剂量BSH对照射后小鼠外周血白细胞、红细胞、血小板的影响, 发现高剂量组在辐照后早期对小鼠外周血血小板计数有升高作用, 中剂量组在辐照后晚期对小鼠外周血血小板计数、胸腺指数、脾脏指数有升高作用。结果表明BSH能有效促进照后血小板的恢复, 对辐照引起的免疫系统损伤有明显的保护作用。实验中观察到BSH对造血系统的保护作用不理想, 认为BSH的给药途径、剂量和次数有待进一步优化。
| [1] |
Singh A, Singh H, Henderson JS. Radioprotection by ascorbic acid, desferal, and mercaptoethylamine[J]. Methods Enzymol, 1990, 186: 686-696. DOI:10.1016/0076-6879(90)86168-U |
| [2] |
Vacek A, Rotkovská D, Bartonícková A, et al. Amelioration of radiation damage to haemopoiesis by Ivastimul, given after irradiation to mice protected by peroral cystamine[J]. Folia Biol (Praha), 1992, 38(6): 323-331. |
| [3] |
Narra VR, Harapanhalli RS, Goddu SM, et al. Radioprotection against biological effects of internal radionuclides in vivo by S-(2-aminoethyl) isothiouronium bromide hydrobromide (AET)[J]. J Nucl Med, 1995, 36(2): 259-266. |
| [4] |
Rades D, Fehlarer F, Bajrovic A, et al. Serious adverse effects of amifostine during radiotherapy in head and neck cancer patients[J]. Radiother Oncol, 2004, 70(3): 261-264. DOI:10.1016/j.radonc.2003.10.005 |
| [5] |
Komaki R, Lee JS, Milas L, et al. Effects of amifostine on acute toxicity from concurrent chemotherapy and radiotherapy for inopera ble non-small-cell lung cancer: report of a randomized comparative trial[J]. Int J Radiat Oncol Biol Phys, 2004, 58(5): 1369-1377. DOI:10.1016/j.ijrobp.2003.10.005 |
| [6] |
Barth RF, Soloway AH, Goodman JH, et al. Boron neutron capture therapy of brain tumors: an emerging therapeutic modality[J]. Neurosurgery, 1999, 44(3): 433-450. DOI:10.1097/00006123-199903000-00001 |
| [7] |
Takagaki M, Oda Y, Miyatake S, et al. Boron neutron capture therapy: preliminary study of BNCT with sodium borocaptate (Na2 B12 H11 SH) on glioblastoma[J]. J Neurooncol, 1997, 35(2): 177-185. DOI:10.1023/A:1005766828165 |
| [8] |
Kageji T, Nagahiro S, Matsuzaki K, et al. Boron neutron capture therapy using mixed epithermal and thermal neutron beams in patients with malignant glioma-correlation between radiation dose and radiation injury and clinical outcome[J]. Int J Radiat Oncol Biol Phys, 2006, 65(5): 1446-1455. DOI:10.1016/j.ijrobp.2006.03.016 |
| [9] |
Wu G, Barth RF, Yang W, et al. Boron containing macromolecules and nanovehicles as delivery agents for neutron capture therapy[J]. Anticancer Agents Med Chem, 2006, 6(2): 167-184. DOI:10.2174/187152006776119153 |
| [10] |
Suzuki M, Masunaga S, Kinashi Y, et al. Intra-arterial administration of sodium borocaptate (BSH)/lipiodol emulsion delivers B-10 to liver tumors highly selectively for boron neutron capture therapy: experimental studies in the rat liver model[J]. Int J Radiat Oncol Biol Phys, 2004, 59(1): 260-266. DOI:10.1016/j.ijrobp.2003.12.018 |
| [11] |
Yoshida F, Matsumura A, Yamamoto T, et al. Enhancement of sodium borocaptate (BSH) uptake by tumor cells induced by glutathione depletion and its radiobiological effect[J]. Cancer Lett, 2004, 215(1): 61-67. DOI:10.1016/j.canlet.2004.06.023 |
| [12] |
Barth RF. A critical assessment of boron neutron capture therapy: an overview[J]. J Neurooncol, 2003, 62(1-2): 1-5. DOI:10.1007/BF02699929 |
| [13] |
Barth RF, Coderre JA, Vicente MG, et al. Boron neutron capture therapy of cancer: current status and future prospects[J]. Clin Cancer Res, 2005, 11(11): 3987-4002. DOI:10.1158/1078-0432.CCR-05-0035 |
| [14] |
李淑萍, 何津祥, 李敏, 等. 不同剂量X射线照射对小鼠胸腺、脾脏、肝脏细胞凋亡及p53基因表达的影响[J]. 辐射防护, 2007, 27(6): 349-361. |
| [15] |
谢漪, 党秉荣, 张红, 等. 低剂量X射线辐射对BALB/C小鼠免疫系统的影响[J]. 辐射研究与辐射工艺学报, 2006, 24(3): 167-170. DOI:10.3969/j.issn.1000-3436.2006.03.010 |
| [16] |
崔玉芳, 丁彦青, 张莹, 等. 致死剂量γ射线照射小鼠脾淋巴细胞凋亡特征及与Bax和Bcl-XL表达的关系[J]. 中国危重病急救医学, 2005, 17(2): 109. DOI:10.3760/j.issn:1003-0603.2005.02.014 |