2. 济南大学山东省医学科学院医学与生命科学学院,山东 济南 250022
2. School of Medicine and Life Sciences, University of Jinan-Shandong Academy of Medical Sciences, Jinan 250022 China
紫茎泽兰(Eupatorium adenophorum spreng)系菊科泽兰属多年生半灌木草本植物。是我国排在第一位的外来入侵植物, 是一种有毒的恶性杂草。自20世纪40年代经中缅、中越边境传入我国, 以其超强的传播能力已在我国特别是西南各省造成严重危害, 它侵占农田、果园、林地, 与农作物争水、肥、阳光和空间, 排挤邻近植物, 对农业的危害性极大[1]。为了防控紫茎泽兰的传播蔓延, 变废为宝, 对紫茎泽兰进行开发利用, 我们将紫茎泽兰有生物活性的化学成份提取加工成生物农药[2], 为了解紫茎泽兰提取物对机体的损伤情况, 我们对该提取物进行了相关的毒理学研究[3], 本文观察了紫茎泽兰提取物对小鼠脾细胞凋亡的影响, 为紫茎泽兰的安全利用提供理论基础。
1 材料与方法 1.1 材料SPF级昆明种小鼠体重20~24 g, 由山东大学实验动物中心提供, 合格证号:SCXK (鲁)2009- 0001号。Annexin V-FTTC试剂盒购自深圳精美生物工程公司。流式细胞仪为美国Becton-Dickinson公司产品。
1.2 脾细胞凋亡检测将动物随机分为4组, 每组20只, 雌雄各半, 剂量分别为0、75、150、300 mg/kg。动物每天经口灌胃给药1次, 连续7 d。7 d后脱椎处死小鼠, 无菌条件下取小鼠脾脏, 留取部分病理检查标本, 剩余标本制成匀浆, 经200目尼龙网过滤及灭菌双蒸水溶解红细胞后, 用RPMI 1640培养液调整细胞的密度为5 × 109/L, 用台盼蓝染色试验检测脾细胞的存活率。将分离的小鼠脾细胞加入到24孔细胞培养板中, 每只小鼠脾细胞悬液设两孔置37℃ CO2孵箱中培养12~16 h。用Annexin V-FTTC染色法, 取制备好的脾细胞悬液100 μL于流式细胞管中, 再加Annexin V-FTTC 5 μL和10 μL PI溶液, 混匀后于室温避光孵育15 min, 在反应管中加400 μL PBS, 流式细胞仪测定。
1.3 脾脏组织病理学检查脾脏组织经乙醇脱水, 二甲苯透明, 常规石蜡包埋, 连续切片, 苏木素-伊红(HE)染色, 光镜下观察。
1.4 统计学处理各组小鼠脾细胞凋亡率采用SPSS13.0单因素方差分析(One-Way ANOVA)进行组间差异的显著性检验。
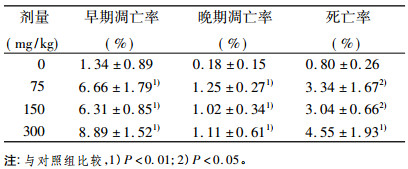
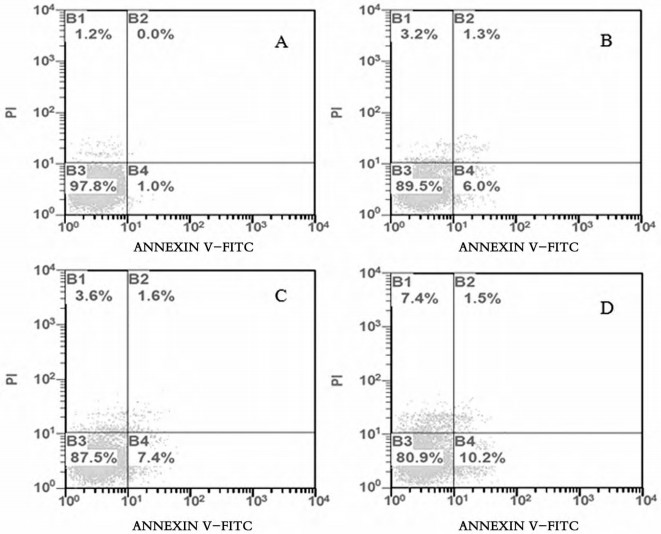
2 结果 2.1 脾细胞凋亡检测紫茎泽兰提取物小鼠脾细胞凋亡实验结果见表 1、图 1, 表 1可见, 紫茎泽兰提取物各组小鼠脾细胞的早期凋亡率、晚期凋亡率及死亡率与正常对照组相比均明显增加, 差异有统计学意义(P < 0.05或P < 0.01)。
|
|
表 1 紫茎泽兰提取物对小鼠脾细胞凋亡率的影响 |
|
图 1 流式细胞仪测定小鼠脾细胞凋亡变化 注: A为对照组; B为75 mg /kg组; C为150 mg /kg组; D为300 mg /kg组。 |
正常对照组小鼠脾脏红、白髓结构清晰, 小梁结构明显, 白髓内含有大量的淋巴细胞。紫茎泽兰提取物各组小鼠脾脏红、白髓界限不清, 白髓减少或消失, 淋巴小结结构破坏, 淋巴细胞数量较少, 排列疏松, 皮质层变薄, 见图 2。

|
图 2 小鼠脾脏组织HE染色切片镜下观察(HE,× 200) 注: A为对照组; B为150 mg /kg组; C为300 mg /kg组。 |
细胞凋亡又称程序性细胞死亡, 是指细胞在一定的生理或病理条件下, 遵循自身的程序, 自己结束生命的过程。它是一个主动的、高度有序的、由基因控制及一系列酶参与的过程, 在保证多细胞生物的健康生存过程中扮演着关键的角色[4]。其形态学特点为核染色质凝聚、边集、细胞膜发泡及凋亡小体形成。流式细胞术是检测细胞凋亡的有力工具, 具有检测的细胞数量大, 可定量的分析群体细胞的凋亡及可同时进行其他相关分析的特点, 目前, 以Annexin V-FTTC联合PI染色进行流式细胞分析应用最为广泛[5, 6]。本文从小鼠脾脏组织病理学和细胞凋亡两个方面观察了紫茎泽兰提取物对小鼠脾细胞的损伤情况, 结果显示, 紫茎泽兰提取物可使小鼠脾脏出现明显的病理改变, 脾细胞早期凋亡率和晚期凋亡率明显增加。由于免疫器官内免疫细胞凋亡率增加, 淋巴细胞数量较少, 可能导致机体免疫功能低下, 使机体清除病原体的能力下降而易发感染, 也可使机体对潜在肿瘤细胞清除不力而易患肿瘤。紫茎泽兰提取物是否具有这种作用有待进一步探讨。
| [1] |
赵国晶, 马云祥. 云南省紫茎泽兰的分布与危害的调查[J]. 杂草学报, 1989, 3(2): 37-40. |
| [2] |
闫乾胜, 杨婕, 李华民, 等. 入侵物种紫茎泽兰化学成分及生物化学研究进展[J]. 北京师范大学学报, 2006, 42(1): 70-73. DOI:10.3321/j.issn:0476-0301.2006.01.016 |
| [3] |
李厚勇, 王蕊, 张振玲, 等. 紫茎泽兰醇提取物对大鼠致畸作用[J]. 中国公共卫生, 2011, 27(12): 1593-1594. DOI:10.11847/zgggws2011-27-12-39 |
| [4] |
陶慧敏, 王文文, 关燕清. 细胞程序式死亡途径的新进展[J]. 细胞生物学杂志, 2008, 30(5): 563-568. |
| [5] |
Kim YK, Kim HJ, Kwon CH, et al. Role of ERK activation in cisplatin-induced apoptosis in OK renal epithelial cells[J]. J Appl Toxicol, 2005, 25(5): 374-382. DOI:10.1002/(ISSN)1099-1263 |
| [6] |
Baxa DM, Lou X, Yoshimura FK. Cenistein induces apoptsis in Tlymphoma cells via mitochondrial damage[J]. Nutr Cancer, 2005, 51(1): 93-101. DOI:10.1207/s15327914nc5101_13 |