微核作为染色体损伤的一种标志, 目前广泛用于放射损伤和诱变剂检测[1]。其检测方法也由初期的外周血液直接制片法进展到目前的细胞培养法, 检出率和准确度也大大地提高。由于其检测方法操作简便、快速、经济实用, 适用于大批量的标本检测, 对职业性放射工作者所受辐射损伤的评价有非常重要意义, 很多职业性检查实验室都开展此项检查。在用普通培养法检测淋巴细胞微核率过程中, 由于外界各种条件因素的影响, 如细菌污染、溶血、培养温度的变化等等, 有时会碰到培养液混浊、溶血或有凝块现象, 制片后镜检可见到有核细胞数量明显减少, 转化率偏低, 细胞生长不良。本报告是通过改变体外细胞培养过程中的温度, 观察培养温度对人血淋巴细胞微核率的影响情况, 为今后微核检测技术的准确诊断减少误差提供科学依据。
1 材料与方法 1.1 仪器与试剂电热恒温培养箱, 普通显微镜, 淋巴细胞培养液(由市场购买, 5.0 mL/安瓿瓶), 有效期内使用。
1.2 试验标本本市医疗放射单位参加职业健康体检的放射工作人员, 随机选取22人(男19人, 女3人, 年龄26~55岁), 早上空腹抽取静脉血液。
1.3 方法 1.3.1 接种培养通过无菌操作技术, 用注射器分别接种0.3~0.4 mL血液标本于四支淋巴细胞培养液(预先解冻至室温)中轻轻摇匀, 分四组培养。一支放置(37 ± 0.5)℃的培养箱中培养72 h, 每日摇匀两次, 为对照组; 实验组A:放置(38.5 ± 0.5)℃培养箱培养72 h, 每日摇匀两次; 实验组B:放置(33 ± 0.5)℃培养箱培养8 h后, 移置(37 ± 0.5)℃培养箱培养8h, 再移回(33 ± 0.5)℃培养箱培培养8 h, 然后又移置(37 ± 0.5)℃ ……如此交替变化温度培养至72 h, 每日摇匀两次; 实验组C:放置(33 ± 0.5)℃培养箱培养72 h, 每日摇匀两次。
1.3.2 制片镜检培养至72 h后收获细胞, 经低速离心(1 000转/min)、低渗、固定、制片、染色后镜检, 每支培养液标本观察1 000个胞浆完整的淋巴细胞, 计数细胞微核率、微核细胞率和转化率。
1.3.3 微核判断标准游离于胞浆中, 呈圆形或椭圆形的核小体, 边缘光滑整齐, 染色质结构与主核相似, 无折光点, 直径为主核的1/3~1/12之间, 与主核分离或相切, 染色与主核一致或略浅[2]。
1.4 统计学处理多组间比较用方差分析, 多组间两两比较用Bonfferonit检验。
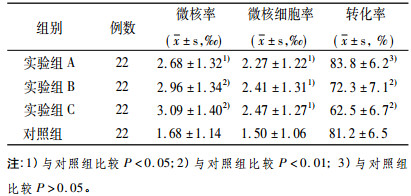
2 结果由表 1中可见, 细胞微核率和微核细胞率:实验组高于对照组(A组t值分别为2.69和2.23; B组t值分别为3.45和2.53; C组t值分别为3.66和2.47), 差异有统计学意义, 实验组各组间比较差异无统计学意义(P > 0.05)。细胞转化率:B组和C组低于对照组(t值分别为4.33和9.40), 差异有统计学意义(P < 0.001), A组与对照组比较差异无统计学意义(P > 0.05)。实验组之间转化率比较, A组高于B组、B组高于C组(t值分别为5.7和4.7), 差异有统计学意义(P < 0.001)。此外, 镜检时可见到C组片中的有核细胞数明显少于对照组和A组, 细胞体积也较小。A组的裸核细胞增多。
|
|
表 1 实验组和对照组微核率、微核细胞率、转化率结果比较 |
有关细胞微核形成的机理, 许多学者认为有两种途径:一是诱变剂(生物、物理和化学等外界因素)随机打断DNA分子形成小分子断片, 该断片由于没有纺锤丝连接, 在随后的细胞分裂过程中无法移向两极而随机分到子细胞中, 不能参与形成子核而凝缩成独立于核之外的微核; 另一是纺锤丝造成细胞纺锤体功能紊乱和结构伤害, 由此产生滞留染色体, 在有丝分裂后期不能分配进子核而形成微核[3]。但也有学者认为, 微核除可来源于细胞分裂后期的染色体断片和落后染色体外, 还可以在细胞间期的各阶段直接形成[4]。本实验通过改变细胞培养过程中的温度可引起淋巴细胞微核率升高, 差异有统计学意义, 提示人血淋巴细胞在体外培养过程中培养温度的升高或降低可诱变微核形成, 其原因可能是人血淋巴细胞长期习惯适应于人体37℃恒温中增殖, 当期在体外培养时温度高于或低于37℃时可导致细胞纺锤体功能紊乱或结构伤害, 在细胞分裂时产生滞留染色体而形成微核, 或者是培养温度的变化对间期核有损伤作用, 其形成的方式如何有待以后的研究进一步探讨。
淋巴细胞转化率在(33~38.5)℃之间随着培养温度降低呈下降趋势, 差异有统计学意义。在33℃培养的C组细胞较化率最低, 只有(61.6 ± 6.7)%, 细胞体积也偏小、胞浆较丰富、胞核位置偏离, 多核细胞(有3~6个细胞核, 每个胞核直径大小相差大于1/3, 细胞体积比未转化细胞略大)增多, 提示培养温度降低时细胞生长不良, 细胞增殖的速度较慢。而A组的细胞较化率最高(84.6 ± 6.7)%, 但片中见到无胞浆的裸核细胞较多, 可能与培养温度较高时细胞受到伤害或易老化有关。
本实验表明, 人血淋巴细胞除了在37℃恒温中生长外, 在(33~38.5)℃的恒温和变温中仍然可生长, 只是生长过程中遗传物质的稳定性较差, 变异频率较高, 不同于其他变温动物那样, 其细胞可以在环境和体温的不断变化中生长, 并能保持遗传的稳定性。
目前已有许多学者研究过影响淋巴细胞微核率的各种因素, 如稀土金属的氯化钇和氯化镨[3]、空气中的二氧化硫[5]、有机气体甲醛[6]、重金属砷[2]、抗癌药物长春新碱[4]、农药敌百虫[7]、香烟烟雾与烟焦油[8]等都能致使微核的形成, 但是对培养温度的变化能引起淋巴细胞微核率升高的相关研究, 这方面还未见有学者报道。因此, 我们认为在今后的微核检测工作中对培养箱进行双重温度的监控, 确保培养箱温度在37℃的相对恒定, 对提高人血淋巴细胞微核检测结果的准确性, 为临床诊断提供准确的诊断依据非常重要。
| [1] |
Hsu TC, Spitz MR, Schantz SP. Mutagen sensitity:A biological marker of canaer susceptitity[J]. Cancer Epidemiol Biomarkers prev, 1991, 1(1): 83-89. |
| [2] |
秦志锋, 游绍阳, 刘运莲, 等. 砷对人淋巴细胞微核率影响的研究[J]. 南华大学学报医学版, 2001, 29(2): 25-27. |
| [3] |
杨辉, 嵇庆, 张锡然, 等. 氯化钇和氯化镨对人血淋巴细胞微核率的影响[J]. 中华预防医学杂志, 1998, 32(3): 59-61. |
| [4] |
薜开先, 马国建, 吴建中. 微核形成与细胞周期关系的初步研究[J]. 遗传学报, 1992, 19(1): 17-21. |
| [5] |
孟紫强, 张连珍, 郑卫萍. 硫酸厂工人外周血淋巴细胞微核率的研究[J]. 环境科学学报, 1989, 9(1): 13-15. |
| [6] |
王立, 韩志英, 孙忠欢. 甲醛接触工人的外周血淋巴细胞微核研究[J]. 癌变畸变突变, 1997, 9(2): 123-124. |
| [7] |
汤艳, 张青碧, 甘仲霖, 等. 杀虫剂诱导人外周血淋巴细胞DNA损伤[J]. 现代预防医学, 2006, 33(8): 1 342-1 343. |
| [8] |
金银龙, 王汉章, 顾珩, 等. 吸烟者与非吸烟者染色体畸变和微核形成的观察[J]. 中华流行病学杂志, 1997, 18(1): 41-43. |