2. 山东省肿瘤医院放疗三病区;
3. 山东省肿瘤医院物理计划室
脑胶质母细胞瘤是成年人最常见的原发性脑恶性肿瘤之一, 占原发性中枢神经系统肿瘤的近25%, 其恶性程度较高, 浸润性较强, 手术完全切除率低, 且单纯手术后几乎毫无例外地出现复发。术后放化疗不但可以延长局部肿瘤复发间隔时间, 而且具有明显的生存优势[1-3]。因此, 术后放化疗是脑胶质母细胞瘤的标准治疗手段。依据脑胶质母细胞瘤的浸润特点, 并考虑到脑干等剂量限制性器官的保护和全脑受照剂量的控制, 脑胶质母细胞瘤术后残留放疗过程中需要对残留病灶及瘤床补量, 以提高高复发风险区照射剂量, 本研究采取调强放疗联合化疗的综合治疗方法, 并比较后续单药替莫唑胺辅助化疗的临床疗效。
1 资料与方法 1.1 选择患者标准① Karnofsky评分﹥ 70分; ②预计生存时间﹥ 6个月; ③已行手术治疗, 术后病理为胶质母细胞瘤; ④术前及术后未行放化疗; ⑤颅脑MRI提示术后残留; ⑥无放化疗禁忌症; ⑦患者和或家属知情并同意。
1.2 一般资料选择自2008年1月至2011年1月住院的56例脑恶性胶质瘤术后残留患者, 男33例, 女23例, 中位年龄60岁(28~71岁), 肿瘤位于左侧35例(额叶15例, 颞叶9例, 顶叶7例, 小脑4例), 右侧21例(额叶9例, 颞叶6例, 顶叶、枕叶各3例)。术中均未完全切除, 术后MRI检查均有残留。残留肿瘤最小为5 mm×8 mm×6 mm, 最大为30 mm×32 mm× 25mm, 中位体积为10 mm×15 mm×12 mm。56例患者无明显症状者33例, 轻度头痛13例, 头晕3例, 单侧肢体乏力3例, 单侧感觉异常2例, 言语不清晰2例。
1.3 治疗方法患者仰卧于适配枕头的头部固定架上, 热塑膜固定, 4.5 mm层厚增强CT连续扫描, 获取CT模拟定位图像。在相同固定体位下行增强MRI扫描, 获得MRI图像。将CT和MRI图像传输至Pinnacle3或Eclipse计划系统工作站, 将CT与MRI图像融合, 在MRI图像上勾画靶区。残留病灶勾画为GTV, GTV外放5 mm为临床靶区(CTV), CTV外放5 mm为计划靶区(PTV); 瘤床勾画为临床靶区(CTV1), CTV1分别外放15 mm、30 mm为计划靶区1(PTV1)和计划靶区2(PTV2), PTV、PTV1、PTV2处方量分别为2.5 Gy/次、2.3 Gy/次、2.0 Gy/次, 5次/周, 共25次, 总量分别为62.5 Gy、57.5 Gy、50.0 Gy。采用Varian直线加速器6 MV X射线照射, 制定正向调强计划, 95%、87%、76%的等剂量曲线分别包绕PTV、PTV1、PTV2, 晶体最大受照射剂量≤ 6 Gy、脑干最大受照射剂量≤ 54 Gy、脊髓最大受照射剂量≤ 45 Gy, 视神经最大受照射剂量≤ 55 Gy。放疗期间有明显症状者, 配合应用甘露醇、地塞米松等对症治疗。
同步放化疗及后续的单药辅助化疗参照Stupp等[9]推荐的方法, 即放疗期间每天早晨口服替莫唑胺(泰道:美国先灵葆雅制药公司)75 mg/m2, 服药1 h后放疗。同步放化疗结束后4 w, 继续给予替莫唑胺150 mg/m2, 连续口服5 d, 28 d为1个周期, 辅助化疗共6个周期。56例患者单纯行同步放化疗者26例为A组, 放化疗结束后继续化疗6个周期者30例为B组。
1.4 观察及随访方法治疗期间, 患者每周行血常规检测, 每4周检测肝肾功能等。同步放化疗结束后1个月复查颅脑MRI, 后2年内每3个月复查1次, 2年后每半年复查1次, 直至随访结束(2012年10月)或死亡。
1.5 疗效评价按照世界卫生组织(WHO)疗效评价标准, 完全缓解(CR):肿瘤完全消失, 并至少维持4周以上, 且无新病灶出现; 部分缓解(PR):肿瘤体积缩小50%以上, 并至少维持4周以上, 且无新病灶出现; 稳定(SD):肿瘤体积缩小不超过50%, 或增大不超过25%;疾病进展(PD):肿瘤体积增大超过25%或出现新病灶。临床有效率=(CR+PR)/(CR+PR+SD+ PD)×100%。
血液学毒性、急性放射性脑损伤及晚期放射性脑损伤参照RTOG制定的放射性治疗分级标准进行评定, 共分为1~4级。
1.6 统计学方法应用SPSS17.0软件进行统计学分析。两组计数资料的比较采用χ2检验; 计量资料采用x±s表示, 两组间比较采用t检验; 总生存率的计算采用Kaplan-Meier法, 显著性检验水准均为双侧检验, 检验水准α=0.05。
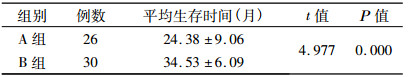
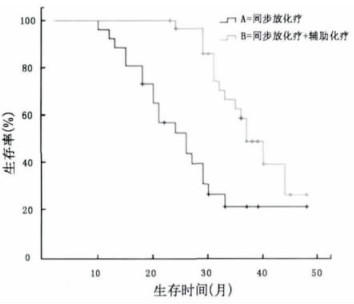
2 结果 2.1 疗效全组56例患者中CR 7例(12.5%), PR 38例(67.8%), SD 8例(14.3%), PD 3例(5.4%); 全组患者的有效率80.3%。全组患者的最短生存时间为10个月, 最长或至随访截止日期为48个月。全组平均生存时间为(29.82±9.11)月; 1 a、2 a、3 a生存率分别为96.4%、73.2%、33.9%, 死亡的患者除3例死于脑出血, 2例死于脑坏死外, 其余均死于肿瘤复发或进展。A组与B组患者的平均生存时间比较如表 1。两组生存曲线比较如图 1。
|
|
表 1 A组与B组患者的平均生存时间比较 |
|
图 1 A组与B组生存比较图 |
主要不良反应为骨髓抑制、恶心、呕吐、头痛、头晕、乏力等。Ⅰ、Ⅱ度白细胞下降9例(16.1%), Ⅲ度白细胞下降4例(7.1%), 无Ⅳ度骨髓抑制者。放射性脑坏死7例(12.5%), 5例经对症治疗后减轻, 2例死亡。无明显记忆力减退、神经损伤及肝肾功能异常等情况的发生。
3 讨论脑胶质母细胞瘤占神经上皮性肿瘤的50%~ 55%, 占成人颅内肿瘤的25%。本病主要发生于成人, 成人中以45~65岁最为多发, 30岁以下年轻患者少见。男性明显多于女性, 男女发病比例为3:2, 本组患者发病中位年龄为60岁(28~71岁), 男女发病比例为1.4:1。脑胶质母细胞瘤的治疗首选手术治疗, 因肿瘤的恶性程度高、呈浸润性生长, 术中难以完全切除, 术后易复发。胶质母细胞瘤患者预后差, 95%未经治疗的患者生存期不超过3个月。目前手术与术后的放疗、化疗结合, 已成为脑胶质母细胞瘤的标准治疗方案, 术后放化疗在脑胶质母细胞瘤的治疗中占重要地位, 术后放化疗可延长患者的生存期[1-3]。
脑胶质母细胞瘤对放疗不敏感, 脑胶质母细胞瘤的α/β值为9.32[4], 理论上增大单次分割剂量可能会使患者获益。本研究采用IMRT放疗方式, 将残留病灶处方剂量设为2.5 Gy/次, 瘤床高复发风险区处方剂量设为2.3 Gy/次, 总量分别为62.5 Gy/25次分割、57.5 Gy/25次分割, 生物效应剂量(biological effetive dose, BED)与常规放疗的66.0 Gy/33次分割、60.0 Gy/33次分割相当, 而且SIB-IMRT的实际临床效应可能优于等效生物剂量相同的常规分割放疗, 而且调强放疗可以缩短患者的住院时间, 从而相应减少医疗费用。既往观点认为改变放疗方式, 即改变分割剂量及分割次数对患者的局部控制率及长期生存无明显影响, 但国内外近来的研究表明低分割放疗可增加疗效[5, 6], 提高局部控制率及延长生存时间, 且调强放疗有明显的剂量学优势, 同时能更好的保护正常器官[7, 8]。
替莫唑胺是口服的烷化剂类抗肿瘤药物, 其生物利用度接近100%, 且能够快速通过血脑屏障, 在中枢神经系统内的浓度可以达到外周血浆药物浓度的40%[9]。该药不良反应较小, 对放疗有增敏作用。单纯口服辅助化疗及放化疗同步应用均有效。已有文献报道大剂量分割联合替莫唑胺化疗效果较好[5, 6]。本研究全组平均生存时间为(29.82±9.11)月; 1 a、2 a、3 a生存率分别为96.4%、73.2%、33.9%;临床效果较好。同步放化疗结束后继续口服替莫唑胺化疗6个周期, 较单纯同步放化疗效果更好。但因为替莫唑胺价格昂贵, 且不在报销范围内, 多数患者是因为经济原因不能继续服用该药。本研究表明同步放化疗后继续口服替莫唑胺化疗效果更好, 两组比较平均生存时间、生存曲线均有统计学差异。
综上所述, 同步加量调强放疗联合替莫唑胺化疗治疗脑胶质母细胞瘤术后残留的临床效果较好, 不良反应可耐受, 建议临床推广应用。但由于本研究病例选择有偏差, 随访时间较短, 尚需要临床进一步扩大样本进行长期的研究验证。
| [1] |
Laperriere N, Zuraw L, Cairncross G, et al. Radiotherapy for newly diagnosed malignant glioma in adults:a systematic review[J]. Radiother Oncol, 2002, 64(3): 259-273. DOI:10.1016/S0167-8140(02)00078-6 |
| [2] |
Tsien C, Moughan J, Michalski JM, et al. Phase I three-dimensional conformal radiation dose escalation study in newly diagnosed glioblastoma:Radiation Therapy Oncology Group Trial 98-03[J]. Int J Radiat Oncol Biol Phys, 2009, 73(3): 699-708. DOI:10.1016/j.ijrobp.2008.05.034 |
| [3] |
Scaringi C, Minniti G, Caporello P, et al. Integrin inhibitor cilengitide for the treatment of glioblastoma:a brief overview of current clinical results[J]. Anticancer Res, 2012, 32(10): 4 213-4 223. |
| [4] |
Deye J, Abrams J, Coleman N. The National Cancer Institute.Guidelines for the use of intensity-modulated radiation therapy in clinical trials[J]. NCTD NCI, 2005, 1-14. |
| [5] |
Malmström A, Grønberg BH, Marosi C, et al. Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma:the Nordic randomised, phase 3 trial[J]. Lancet Oncol, 2012, 13(9): 916-926. DOI:10.1016/S1470-2045(12)70265-6 |
| [6] |
Reddy K, Damek D, Gaspar LE, et al. Phase Ⅱ trial of hypofractionated IMRT with temozolomide for patients with newly diagnosed glioblastoma multiforme[J]. Int J Radiat Oncol Biol Phys, 2012, 84(3): 655-660. DOI:10.1016/j.ijrobp.2012.01.035 |
| [7] |
邵倩, 孙涛, 李建彬, 等. 多发脑转移瘤同期加量适形调强与序贯适形放疗计划不同剂量参数比较[J]. 中华放射医学与防护杂志, 2009, 29(4): 410-411. DOI:10.3760/cma.j.issn.0254-5098.2009.04.017 |
| [8] |
卢洁, 吴朝霞, 张桂芳, 等. 脑胶质瘤三维适形放射治疗与调强放射治疗的剂量学比较[J]. 中华放射医学与防护杂志, 2009, 29(5): 499-501. DOI:10.3760/cma.j.issn.0254-5098.2009.05.011 |
| [9] |
Stupp R, Dietrich PY, Ostermann Kraljevic S, et al. Promising survival for patients with newly diagnosed glioblastoma multiforme treated with concomitant radiation plus temozolomide followed by adjuvant temozolomide[J]. J Clin Oncol, 2002, 20: 1375-1382. DOI:10.1200/JCO.2002.20.5.1375 |