非小细胞肺癌(NSCLC)属恶性呼吸系统肿瘤, 大多数呈浸润性生长, 且与周围肺组织边界不清。放射治疗是NSCLC最有效的辅助治疗方法, 但NSCLC细胞有较强的辐射抗性[1], 正常肺组织的耐受剂量不足以杀死, 因此增加肿瘤组织的辐射敏感性, 减少正常组织的损伤, 提高治疗效果尤为重要。研究发现, COX-2在许多恶性肿瘤中高表达, 并与辐射敏感性成负相关[2]。本研究采用COX-2抑制剂塞来昔布(celecoxib), 观察其对NSCLC细胞系H460细胞放疗敏感性的影响, 并对其增敏机制进行初步探讨。
1 材料与方法 1.1 细胞株H460细胞株购自中国医学科学院细胞中心。
1.2 动物和试剂Balb/c裸鼠购自中国医学科学院动物中心, 5~6周龄, 体重16~19 g, 饲养于SPF级实验室。塞来昔布为西尔制药厂波多黎各分厂出厂。医用直线加速器23OOC/D型购自美国瓦里安公司, 室温下用剂量率4 Gy/min。鼠抗人肿瘤共济失调一毛细血管扩张症突变蛋白(ATM)单克隆抗体(美国Exalpha公司)购自晶美生物工程有限公司, 工作浓度为1:200。表皮生长因子受体(EGFR)兔抗人多克隆抗体购自武汉博士德生物工程有限公司, 工作浓度均为1:100。
1.3 细胞培养H460细胞培养于含10%胎牛血清的DMEM培养基中, 37℃, 5% CO2培养箱中常规培养, 0.25%胰酶消化传代。
1.4 裸鼠肿瘤模型建立裸鼠15只, 随机平均分成三组:A组为对照组、B组为放疗组、C组为塞来布昔+放疗组。裸鼠皮下接种肿瘤, 每只接种2 × 107个细胞。当肿瘤长到5 mm × 5 mm时, 认为模型建立成功。模型建立一周后, 用灌肠法给予塞来昔布16 mg/kg/d, 6 MeV电子线等中心照射, 照射剂量5 Gy/次。4周后处死裸鼠, 剥离瘤组织进行质量称量。并制作标本做免疫组化检测。
1.5 免疫组化检测石蜡标本经二甲苯脱蜡、酒精脱苯和水化切片后, PBS冲洗, 以过氧化氢阻断内源性过氧化酶的活性, 加50 μL一抗后室温下孵育60 min, 再加生物素二抗50 μL (SPKit液), 孵育10 min, 然后加入50 μL链亲和素过氧化物酶溶液室温下孵育10 min, 加入新鲜配制的DAB溶液。冲洗后, 苏木素复染, 中性树胶封固, 光镜下检测。
2 结果 2.1 塞来布昔辐射增敏作用塞来布昔联合放射治疗能显著抑制裸鼠H460细胞的增殖(表 1), 与塞来昔布组比较差异有统计学意义(P < 0.01)。
|
|
表 1 裸鼠经照射后各组瘤重量 |
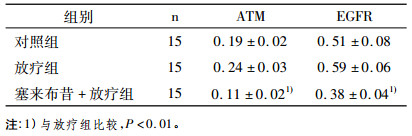
选取5个不同视野, 经全自动医学彩色图像分析系统分析处理, 得到5个视野的平均光密度值(average light density, ALD), 代表ATM蛋白、EGFR的表达水平。ALD越大, 表明表达水平越高。结果显示, 塞来布昔+放疗组与放疗组比较, ATM表达差异有统计学意义(P < 0.01);塞来布昔+放疗组与放疗组比较, EGFR表达差异亦有统计学意义(P < 0.01), 见表 2。
|
|
表 2 免疫组化法对ATM和EGFR平均光密值统计结果亦有统计学意义 |
COX-2是催化花生四烯酸转化为前列腺素E的限速酶, 定位于细胞质和核膜, 静息时不表达, 由细胞因子、有丝分裂原和癌基因等刺激产生, 可促进肿瘤细胞的发生和发展。COX-2抑制剂可抑制肿瘤生长, 在某些肿瘤中尚可增强肿瘤对放射治疗的敏感性, 但其机制尚不明确[3]。
本研究以COX-2选择性抑制剂塞来昔布为研究对象, 证实其能增强荷瘤裸鼠对放疗的敏感性。ATM基因是与DNA损伤修复有关的基因, 研究表明, ATM基因在肺癌中的表达和病理分级, 即恶性程度呈正相关, 而且它表达量越高, 放射敏感性越低[4]。关于EGFR增加辐射抵抗的研究已很多, 大家一致认为, 它的扩增是肺癌细胞放射不敏感的原因, 有人把EGFR作为靶点, 用siRNA干扰, 可明显增加放疗敏感性而取得成功[5]。本实验研究发现, 塞来昔布对ATM和EGFR的表达有显著影响, 提示塞来昔布可能是通过提高ATM和EGFR表达水平, 从而增加H460的放疗敏感性, 此结论尚需进一步实验研究加以证实。
由于Celecoxib是选择性抑制剂, 在正常肺组织表达量低, 因此对正常肺组织影响较小, 并且有报道[6]表明它具有减轻放射性肺损伤的作用, 因此塞来昔布将极有可能成为一个理想的治疗肺癌的放射增敏剂。
| [1] |
Bmndani Da Roeha A, Regner A, Grivicich I, et al. Radioresistance is associated to increased Hsp70 content in human glioblas-toma cell lines[J]. Int J Oncol, 2004, 25: 777-785. |
| [2] |
Matuschek C, Bölke E, Nawatny J, et al. Bevacizumab as a treatment option for radiation-induced cerebral necrosis[J]. Strahlenther Onkol, 2011, 187(2): 135-139. DOI:10.1007/s00066-010-2184-4 |
| [3] |
Sminia P, Kuipers G, Geldof A, et al. COX-2 inhibitors act as radiosensitizer in tumor treatment[J]. Biomed Pharmacother, 2005, 59: 272-275. DOI:10.1016/S0753-3322(05)80044-7 |
| [4] |
Roy K, Wang L, Makrigiorgos GM, et al. Methylation of the ATM promoter in glloma cells alters ionizing radiation sensitivity[J]. Biochem Biophys Res Commun, 2006, 344: 821-826. DOI:10.1016/j.bbrc.2006.03.222 |
| [5] |
Saydam O, Glauser DL, Heid I, et al. Herpes simplex virus amplicon vector-mediated siRNA targeting epiderm al growth factor receptor inhibits growth of human glioma cell in vivo[J]. Molecular Therapy, 2005, 12: 803-812. DOI:10.1016/j.ymthe.2005.07.534 |
| [6] |
Khan R, Krasin M, Kasow K, et al. Cyclooxygenase-2 inhibition to treat mdiation_induced brain necrosis and edema[J]. Pediatr Hematol Oncol, 2004, 26: 253-255. DOI:10.1097/00043426-200404000-00008 |