放射治疗的目的就是为了给予肿瘤足够的致死剂量, 而尽量减少周围正常组织的剂量。随着放射治疗技术的不断发展, 三维适形技术(3D-CRT)和调强放射治疗技术(IMRT)可以给予肿瘤靶区高度适形的剂量分布, 从而减少周围正常组织的剂量[1]。为了获得更好的肿瘤控制率, 减少重要器官与正常组织的照射剂量, 精确的肿瘤定位至关重要。胸部肿瘤由于易受肺的呼吸动度影响, 它的固定与摆位的误差通常较大, 周围正常组织的受照剂量会限制对肿瘤部位的加量[2]。图像引导的放射治疗技术(IGRT), 特别是基于大面积非晶硅数字化X射线探测板的锥形束CT (CBCT)在临床上的广泛应用, 极大地提高了胸部肿瘤的放射治疗的摆位精度[3]。机载CBCT采用圆轨迹的采集方式, X射线球管以病人头脚方向为轴在一个圆轨迹上旋转一周, 位于球管对侧的平板探测器采集投影数据, 利用这些投影数据进行重建, 得到患者当前体位的CBCT体层影像。将计划CT图像和CBCT重建图像进行配准, 得到摆位误差, 然后对误差进行在线校准, 从而实现精确的摆位, 精确放疗[4]。本文主要利用机载kVCBCT来研分析究胸部肿瘤三种不同固定方式的摆位误差, 来探讨三种固定方式的精度及CBCT在胸部肿瘤中的应用。
1 材料与方法 1.1 病人资料与固定方式从2012年2月到6月, 随机统计我科接受放疗的胸部肿瘤患者90例, 其中肺癌50例, 食管癌40例; 患者最大年龄87岁, 最小年龄32岁, 中位年龄55岁。
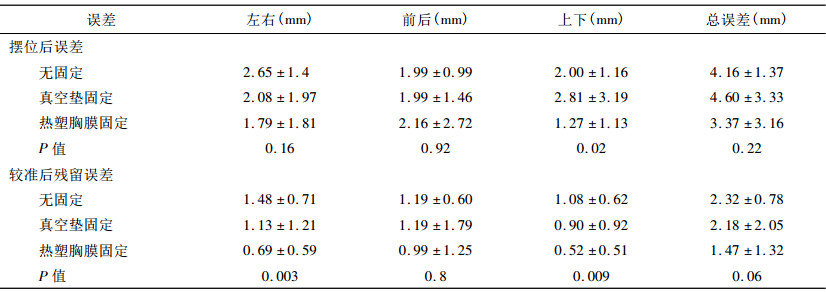
根据病人的体位固定方式, 将病人分为三组, 每组30例。A组病人不采用任何固定措施定位, 主要依据体表标记与激光灯进行摆位。病人脱去上衣平躺在CT碳纤维床上, 双手交叉放头顶, 均匀呼吸, 放置定位参考标记铅点, CT扫描完成后在病人皮肤上画定位标记线。B组病人采用真空体模垫固定。患者躺在真空体模垫上, 调整到舒适体位, 双手交叉放在头顶, 均匀呼吸, 然后用真空泵抽气, 使真空垫变硬定型。患者躺在真空垫上完成CT扫描, 同样在皮肤或真空垫上画标记线。C组病人采用热塑体罩固定, 双手抱头, 均匀呼吸。热塑体罩从恒温水箱中取出后, 紧贴患者皮肤, 两边同时均匀用力拉伸体罩, 固定在体架底座上, 尤其注意肋弓的塑形。完成CT扫描后, 在体罩上标记定位标记线, 同时在患者皮肤上通过网格标记定位标记及体罩的上下界位置, 以保证摆位的重复性和精确性。具体的固定方式如图 1所示。
|
图 1 胸部肿瘤的放疗固定方式 |
所有患者在Philips 16排大孔径螺旋CT下进行扫描, 层厚为3mm。用Pinnacle ACQsim进行定位后, 再用Pinnacle 3计划系统(Philips Medical System)进行计划设计, 根据医生的要求或临床需要, 分别为每个患者制作适形或调强计划。计划完成后传至网络与验证系统MOSAIQ (R&V, IMPAC Medical Systems, Inc., Sunnyvale, CA, USA), 在Elekta Synergy加速器(Elekta Ltd., Crawley, UK)上执行。技术员先根据模拟定位的标记对患者进行摆位, 再根据计算给出的肿瘤中心进行移位, 将患者的治疗中心移到加速器的中心。
医科达(Elekta) Synergy上安装的为千伏级(kV)级的锥形束CT(XVI)。由可伸缩的X射线源和不定型非晶硅平板探头组成。CBCT的光束轴与加速器MV光束轴垂直。可通过选择不同的长与宽来选择不同的射野大小。射野的宽度即为视野(field of view, FOV), 方向与拍片系统的旋转轴垂直。
1.3 CBCT扫描 1.3.1 CBCT图像获取与重建把患者按CT定位时的状态摆位在加速器治疗床上, 设置好配准框和扫描条件行CBCT扫描。胸部肿瘤采用chest M20-cw序列, CBCT参数设置如下: M20准直器, F1虑线器, 非晶硅探测板medium位置, 机架角从180°到180°, 顺时针(cw)旋转一周, 转速180°/min, 管电压120 kV, 1 056 mAs, 采集660帧图像。把扫描得到的图像用XVI软件进行重建, 得到三个层面的三维容积图像, 如图 2所示。

|
图 2 XVI CBCT图像配准与摆位误差计算 |
把得到的三维容积图像, 按照三个层厚, 采用骨配准自动配准, 得到绿紫色的配准图像, 绿紫色的多少表示配准的程度, 图像紫色越多表明配准度越高, 越准确, 反之, 绿色越多表明配准度越低, 误差越大。在配准后的对话框里会显示出患者摆位后CBCT图像和计划参考CT图像的在X(床左右)、Y(床进出)、Z(床升降)方向上的线性误差, 此组数据为校正前误差。把这些误差数据输入图像引导系统, 利用六维床在线校正上述误差, 然后继续采用相同条件行第二次CBCT扫描, 得出第二组误差数据, 此组数据为校正后误差。三维总的误差为(X2 + Y2 + Z2)1/2。
1.4 统计分析One-way ANOVA (SPSS17.0), P < 0.05为差异有统计学意义。
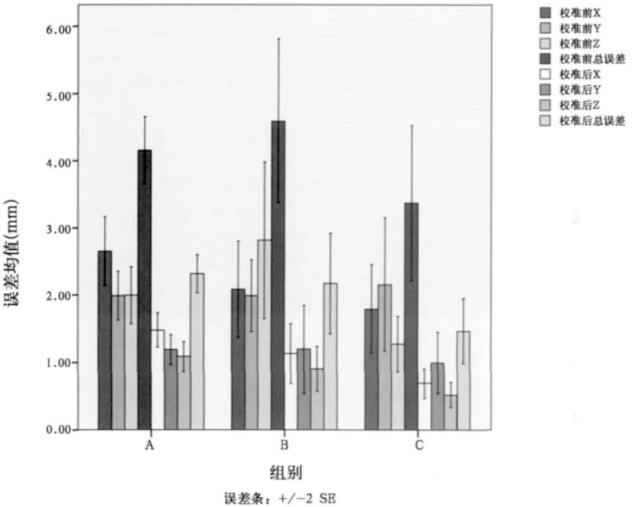
2 结果采集90例患者, 共扫描180次, 得出180组误差数据, 摆位完成后误差和校准后的残留误差如图 3所示, 三种定位方式具体的误差平均值与标准差比较如表 1所示。
|
图 3 三种固定方式摆位误差与校准后残留误差结果 |
|
|
表 1 三种固定方式摆位误差比较结果 |
胸部肿瘤由于受肺呼吸动度的影响,它的精确摆位一直是放射治疗所要面临的巨大挑战之一。本文探讨的三种胸部肿瘤的固定方式, 并用CBCT验证与校准它们的摆位误差, 结果显示三种固定方式的初始摆位误差无统计学意义, 但经CBCT验证校准后, 热塑体罩可获得较小残留误差, 提高摆位精度。
由图 3的误差分布图可以看出, 采用CBCT对摆位进行在线校正后, 可以显著地减少三种固定方式的摆位误差。表 1的误差统计分析得出, 三种固定方式的总误差相比校准前分别减少了1.84, 2.42和1.9 mm。胸部热塑体罩固定可以限制呼吸在上下(Z)方向的位移, 因此, 在此方向上, 胸部热塑体罩的摆位误差要比其他两种固定方小(P = 0.02), 而在左右与前后方向上, 三种固定方式的摆位误差并没有统计学差异。总的摆位误差热塑胸膜固定也相对较小, 但没有统计学意义。在线校准后, 胸部热塑体罩的残留误差明显小于无固定摆位与真空垫摆位。在左右与上下方向, 胸部热塑体罩都可很好地限制患者的物理移动, 获得比其他两种固定方式小的多的残留误差, P值都 < 0.01(分别为0.003与0.009)。前后方向为肺的呼吸移动方向, 胸部热塑体罩也无法进行限制, 所以它们之间的误差相差不大, 没有统计学意义。经CBCT校准后, 胸部热塑体罩的残留总误差比另外两种固定方式都要小(P = 0.06)。
提高胸部肿瘤的摆位精度, 可以减少靶区的扩展边界, 对肿瘤靶区进行加量, 从而可能提高肿瘤的局控率[5]。二维射野验证片一直是验证和提高胸部肿瘤摆位精度的主要工具[6], 但由于二维射野验证片所用的兆伏级X射线本身的限制, 验证片不能很好地分辨软组织结构和其它解剖结构[7]。机载CBCT的出现, 可以在重建患者的三维解剖结构, 进一步提高摆位的重复性, 并对患者的摆位误差进行实时地校准[8]。已经有多个研究报道, 利用CBCT可以极大地减少摆位误差。Li W等报道利用CBCT可以将真空垫的左右, 前后与上下的系统误差从2.4, 5.5, 和3.9 mm降低到1.0, 0.8和1.3 mm[9]。Wang J等报道了CBCT可以将热塑体罩在左右, 前后与上下方向的系统误差从2.1, 4.2, 和2.4 mm减少到0.4, 0.6, 和0.7 mm [10]。这结果也与本研究热塑体罩在各个方向的误差相近。
综上所述, 对于三种胸部肿瘤的固定方式, 经过CBCT的校准, 可以明显地减少它们的摆位误差。胸部热塑体罩由于其良好的物理限制, 经CBCT校准后它的残留误差最小。
| [1] |
Ezzell, G A, Burmeister JW, Dogan N, et al. IMRT commissioning: multiple institution planning and dosimetry comparisons, a report from AAPM Task Group 119[J]. Medical Physics, 2009, 36(11): 5359-5373. DOI:10.1118/1.3238104 |
| [2] |
Allen AM, Siracuse KM, Hayman JA, et al. Evaluation of the influence of breathing on the movement and modeling of lung tumors[J]. Int J Radiat Oncol Biol Phys, 2004, 58: 1251-1257. DOI:10.1016/j.ijrobp.2003.09.081 |
| [3] |
Grills IS, Hugo G, Kestin LL, et al. Image-guided radiotherapy via daily online cone-beam CT substantially reduces margin requirements for stereotactic lung radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2008, 70: 1045-1056. DOI:10.1016/j.ijrobp.2007.07.2352 |
| [4] |
Bissonnette JP, Balter PA, Dong L, et al. Quality assurance fo r image-guided radiation therapy utilizing CT-based technologies: A report of the AAPM TG-179[J]. Med Phys, 2012, 39(4): 1946-1963. DOI:10.1118/1.3690466 |
| [5] |
Nelson, C, Starkschall C, Chang JY. The potential for dose escalation in lung cancer as a result of systematically reducing margins used to generate planning target volume[J]. Int. J. Radiat. Oncol. Biol. Phys, 2006, 65: 573-586. DOI:10.1016/j.ijrobp.2006.01.032 |
| [6] |
Nutting CM, Khoo VS, Walker V, et al. A randomized study of the use of a customized immobilization system in the treatment of prostate cancer with conformal radiotherapy[J]. Radiother. Oncol, 2000, 54: 1-9. DOI:10.1016/S0167-8140(99)00181-4 |
| [7] |
Jaffray DA. Emergent technologies for 3-dimenstional imageguided radiation delivery[J]. Semin. Radiat. Oncol, 2006, 15: 208-216. |
| [8] |
Oldham M, Letourneau D, Watt L, et al. Cone-beam-CT guided radiation therapy: A model for on-line application[J]. Radiother. Oncol, 2005, 75: 271-278. |
| [9] |
Li W, Moseley DJ, Bissonnette JP, et al. Setup reproducibility for thoracic and upper gastrointestinal radiation therapy: influence of immobilization method and on-line cone-beam CT guidance[J]. Medical Dosimetry, 2010, 35(4): 287-296. DOI:10.1016/j.meddos.2009.09.003 |
| [10] |
Wang J, Zhong R, Bai S, et al. Evaluation of positioning accuracy of four different immobilization using cone-beam CT in radiotherapy of non-small-cell lung cancer[J]. Int. J. Radiation. Oncology Biol. Phys, 2010, 77(4): 1274-1281. DOI:10.1016/j.ijrobp.2009.09.049 |