拟除虫菊酯(Pyrethroids)是一类重要的农药杀虫剂, 自1970年代后期以来已经被广泛的应用于农业, 公共卫生和家庭。拟除虫菊酯类农药具有一定毒性。研究表明, 长期接触可对人体的免疫系统、神经系统和生殖系统产生健康危害[1, 2]。生物监测可以反映人体接触毒物的程度及可能的潜在健康影响。关于拟除虫菊酯类农药人体代谢物及其生物监测方法近期已成为研究热点[3, 4]。
目前用于拟除虫菊酯类农药代谢产物的检测方法主要有气相色谱-质谱法[5], 液质谱联用技术[6]等。气相色谱-质谱法(GC-MS)具有灵敏度高, 重复性好, 有化合物数据库鉴定已知物等优点, 但其局限性是衍生试剂毒性大, 衍生过程繁琐。液质联用技术能够分离鉴定复杂化合物, 但是其缺点是没有商品化的谱库可对比查询, 不能满足复杂多样代谢物研究的需要。本研究建立了对拟除虫菊酯类农药的标志性代谢产物3-苯氧基苯甲酸(3-PBA)及常用的Ⅱ型拟除虫菊酯农药氰戊菊酯(fenvalerate)采用固相萃取技术, 反向高效液相(HPLC)的检测方法。
1 材料与方法 1.1 仪器Agilent-1100高效液相色谱仪; 二级管阵列检测器HY-5回旋式振荡器; Milli-Q超纯水机; DCY-24S氮吹仪; TDZ5-WS台式多管低速离心机。
1.2 主要材料和试剂3-PBA (纯度:99%), 购自ACROS; 氰戊菊酯(纯度:99%), 购自J&K; 乙腈(色谱纯); 甲醇(色谱纯); C18 SEP-PAK小柱(Waters公司)。
1.3 标准曲线取1 ml新鲜晨尿, 分别添加标准溶液配制成浓度为2、5、20、40、80 μg/ml的尿样标准系列, 按照1.4项规定进行样品前处理并进样分析。
1.4 样品前处理C18 SEP-PAK小柱的前处理:将C18 SEP-PAK小柱先用3ml乙腈处理, 再用3 ml纯水平衡。尿样的前处理:取1 ml尿样至离心管中, 加入后浓盐酸混匀, 漩涡振荡30 s, 然后再2 500 rpm/ min的转速离心5 min。取上层有机相1 ml到处理后的C18 SEP-PAK小柱上, 用6 ml的水进行淋洗, 再用2 ml的甲醇和乙腈进行洗脱。移取洗脱液并在室温下用N2吹剩至约500 μl, 加乙腈至1 ml, 在旋涡振荡器上充分混匀并用0.45 μm的滤膜过滤后进行HPLC分析。
1.5 色谱条件色谱柱Zorbox SB C18色谱柱(4.6 × 250 nm × 5 μm); 流速1 ml/min; 流动相A:0.5%磷酸/水溶液, 流动相B:乙腈; 梯度洗脱程序:t=0 min, 70% B; t=2.8 min, 70% B; t=3 min, 90% B; t=3.8 min, 100% B; t=5 min, 100% B; t=6 min, 90% B; t=8 min, 70% B; 进样体积:10 μl; 检测波长:220 nm。
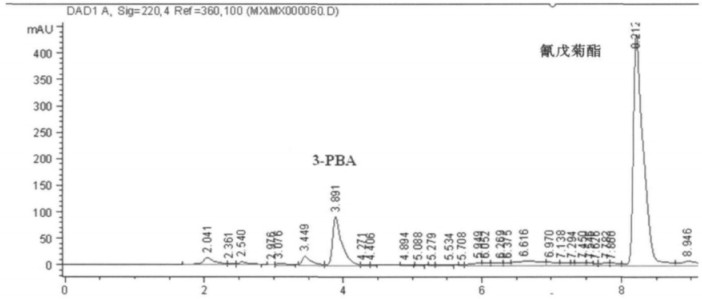
2 结果与讨论 2.1 色谱柱的选择本研究针对生物监测在样品量和灵敏度上的特点, 尝试了在HPLC中几种常用色谱柱, 如Eclipse XDB-C18(4.6 × 150 mm × 5 μm)、Extend-C18(4.6 × 150 mm × 5 μm)、Eclipse XD-C18 (4.6 × 250 mm × 5 μm), 最终选用Zorbox SB C18(4.6 × 250 nm × 5 μm)色谱柱作为分离柱, 在本试验条件下, 氰戊菊酯及其代谢产物3-PBA在10 min内实现完全分离。(图 1)
|
图 1 氰戊菊酯及其代谢产物3-PBA标准品色谱图 |
先选用甲醇和水作流动相, 经不断调整比例, 但其保留时间和峰形均不理想; 换用乙腈和0.5%磷酸/水溶液作流动相, 经不断改变二者比例, 最终选定了梯度洗脱程序, 峰形较好, 洗脱效率较高。
2.3 样品前处理条件的选择尿样的前处理(净化)是检测尿中氰戊菊酯及其代谢产物3-PBA的关键步骤。尿样的分析误差主要来源于样品前处理。本研究尝试液-液萃取后以N, (特丁基二甲基硅烷基)- N-甲基三氟乙酰胺作为衍生试剂进行衍生化反应以及盐酸水解后用正己烷提取, 硫酸-甲醇甲酯化等几种方法来处理样品, 其结果均不理想。最终选用酸水解后, C18 SEP-PAK固相萃取, 甲醇和乙腈洗脱的方法进行样品处理。
2.4 方法学验证 2.4.1 线性范围与线性方程(表 1)|
|
表 1 氰戊菊酯及3-PBA标准曲线性能指标 |
本方法以3倍信噪水平计算。在本试验中, 氰戊菊酯和3-PBA的检出限分别为0.78 μg/ml和1.93μg/ml。
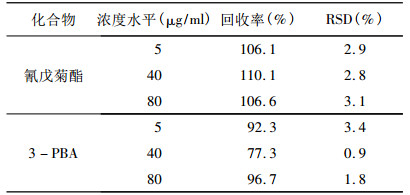
2.4.3 精密度选择测定方法线性范围内取5、40、80 μg/ml三种浓度, 每种浓度分析2~3个样品, 求平均值, 连续重复6次, 计算相对标准偏差。结果见表 2。结果可见, 两种目标化合物RSD均小于10%。
|
|
表 2 尿加标回收率及相对标准偏差 |
应用加标回收法。在现场样品中各加入5、40、80 μg/ml三种浓度的氰戊菊酯和3-PBA的标准溶液, 然后测定样品和加标样品, 各测定3次, 由平均值计算加标回收率。准确度用接触者样品的加标回收率表示, 结果见表 2。结果可见, 两种目标化合物回收率均大于75%。
2.2.5 样品稳定性试验取3个不同的尿样, 制备一个新鲜的合并样品, 分成4组, 每组6个。普通冰箱(4℃)保存。与当天、第3天、第7天、第14天各分析1组, 各组均值与当天的均值比较, 计算相对标准偏差。结果得出, 尿样在普通冰箱4℃保存, 两周之内相对偏差小于8.93%。
3 结论在哺乳动物中, 拟除虫菊酯通过清除中央酯链进行快速代谢, 从而生成不同的代谢产物[7], 且这些代谢产物活性远高于化学物原形[8]。由于代谢速度较快, 拟除虫菊酯在血液中的浓度比尿液中低很多。因此, 检测尿液中的代谢产物被认为是评价拟除虫菊酯实际暴露水平的有效手段。在已知的拟除虫菊酯尿液代谢产物中, 3-PBA是氯氰菊酯、氰菊酯和其他拟除虫菊酯的主要代谢产物。检测尿液中这种拟除虫菊酯共同代谢产物的水平可以反映多种拟除虫菊酯的复杂环境暴露。此外, 3-PBA也是普通人群中检出率最高的拟除虫菊酯代谢产物, 其性质稳定, 提取方法简便, 故可以将它作为拟除虫菊酯农药生物监测的主要实验室指标[5, 9]。
在样品处理技术上, 卢大胜[10]在拟除虫菊酯代谢产物的尿样处理中过程中需要将样品用正己烷重复提取及需要衍生水浴, 其过程复杂。金玉娥[6]在检测拟除虫菊酯代谢产物时, 也需要将样品高温酸化水解较长时间, 其效果不稳定。而本方法采取了C18 SEP-PAK萃取技术无疑大大缩短了检测时间, 提高了效率。
本研究采用反向HPLC法检测尿液中氰戊菊酯及其主要代谢产物3-PBA, 该法的线性范围宽, 检测限低, 且样品的处理过程简单, 分析时间短、灵敏度较高、结果重复性较好, 符合《工作场所有害物质监测方法》的要求, 能够满足测定人尿液中氰戊菊酯及其代谢产物3-PBA的需要, 从而预测其暴露水平, 并为拟除虫菊酯类农药的安全性评价提供依据。
| [1] |
毛金超, 李秋云. 果蔬中拟除虫菊酯类农药残留的危害与检测[J]. 科技信息, 2009(16): 324-326. DOI:10.3969/j.issn.1001-9960.2009.16.281 |
| [2] |
Hideo Kaneko, Junshi Miyamoto. Pyrethroid Chemistry and Metabolism.Handbook of pesticide toxicology (Second Edition)[M]. Academic Press, 2001: 263-1 288.
|
| [3] |
Schulz C, Conrad A, Becker K, et al. Twenty years of the German Environmental Survey (GerES):human biomonitoring temporal and spatial (West Germany/East Germany) differences in population exposure[J]. Int J Hyg Environ Health, 2007, 210(3-4): 271-297. DOI:10.1016/j.ijheh.2007.01.034 |
| [4] |
Angerer J, Ewers U, Wilhelm M, et al. Human biomonitoring:State of the art[J]. Int J Hyg Environ-Health, 2007, 210(3-4): 201-228. DOI:10.1016/j.ijheh.2007.01.024 |
| [5] |
Gabriele Leng, Wolfgang Gries. Simultaneous determination of pyrethroid and pyrethrin metabolites in human urine by gas chromatography-high resolution mass spectrometry[J]. Journal of Chromatography B, 2005, 814(2): 285-294. DOI:10.1016/j.jchromb.2004.10.044 |
| [6] |
金玉娥, 卢大胜. 液质联机测定尿中拟除虫菊酯类农药代谢物的方法研究[J]. 上海预防医学, 2012, 24(6): 289-292. DOI:10.3969/j.issn.1004-9231.2012.06.001 |
| [7] |
Dorman DC, Beasley VR. Neurotoxicology of pyrethrin and the pyrethroid insecticides[J]. Vet.Hum.Toxicol, 1991, 33(3): 238-243. |
| [8] |
Tyler Charles R., Beresford Nicola, Melanie van der Woning, et al. Metabolism and environmental degradation of pyrethroid insecticides produce compounds with endocrine activities[J]. Environ.Toxicol.Chem, 2000, 19(4): 801-809. DOI:10.1002/etc.v19:4 |
| [9] |
Hardt J, Angerer J. Biological monitoring of workers after the application of insecticidal Pyrethroids[J]. Int Arch Occup Environ Health, 2003, 76(7): 492-498. |
| [10] |
卢大胜, 金玉娥, 周志俊, 等. 尿中拟除虫菊酯类农药代谢产物GC-MS测定方法研究[J]. 卫生研究, 2011, 40(3): 371-374. |