胰腺癌是常见恶性肿瘤之一,2009年美国预计新发病例42 470例,死亡35 240例,为第十大常见恶性肿瘤,但死亡人数居癌症第四位[1]。我国胰腺癌发病率逐年上升,近20年增长了4倍,胰腺癌总体5年生存率低于5%。大多数患者就诊时局部进展或者出现转移,仅15% ~ 20%患者可手术切除。不能手术切除但暂无远处转移的局部晚期胰腺癌占胰腺癌的40%左右[2]。同步放化疗对不能手术切除患者最有效的治疗手段之一。吉西他滨是目前胰腺癌最为有效的化疗药物,同时它具有放疗增敏作用,故我科开展了局部晚期胰腺癌同步放化疗治疗。
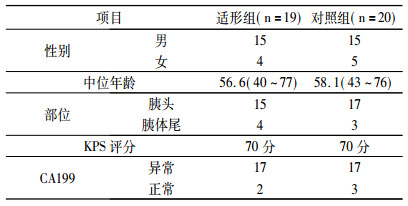
1 资料与方法 1.1 临床资料全组39例患者,KPS评分>70分,无重大基础疾病,无放化疗禁忌症,三大常规正常,肝肾功能正常,心电图基本正常,三维适形放疗为适形组,吉西他滨单药化疗为对照组。见表 1。
|
|
表 1 临床病例资料 |
① 单药吉西他滨1 000 mg /m2,30 min内滴完,每周一次,连用3周,休1周,4周为1周期; ②同步放化疗吉西他滨放疗前1天,600 mg /m2,每周一次,共7周。
1.2.2 适形放疗定位前1小时分次口服20%泛影葡胺20 ml +清水800 ml,患者仰卧,双手抱头置额,体膜固定,待热塑膜成形后,激光灯下标记前野,两个侧野中心,行CT扫描,胸骨角至髂前上棘水平,层厚5 mm。将带有体架的CT扫描结果传入治疗计划系统中,准确勾画肿瘤靶体积(GTV)包括原发灶和转移的淋巴结,临床靶体积(PTV)为在GTV基础上外放1 ~ 1.5 cm,并标记出周围的重要器官,包括胃、双肾、肝脏、十二指肠和照射范围内的小肠、结肠和脊髓。利用手动多叶光栅,设计5 ~ 7个不同角度共面不对称照射。以85 ~ 90%等剂量曲线包括CTV,并作为处方剂量线,6MV-X射线照射,每周5次,1.8 ~ 2 Gy /次,总剂量60 ~ 66 Gy。
1.3 疗效评价治疗后4周行影像学检查,按WHO实体瘤疗效评价标准分完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),以CR + PR计算有效率,CR + PR + SD计算疾病控制率(DCR); 急性毒副反应按照RTOG进行评价; 参照Gelibter分级法[3],将CA199分为4个水平,CA199下降>75%为CR,下降25 ~ 75%为PR,25%-无变化为SD,升高为PD。
1.4 采用SPSS13.0统计软件包处理等级资料用Kruskaluallis秩和检验,构成比用χ2检验进行比较,以P<0.05为差异有统计意义。
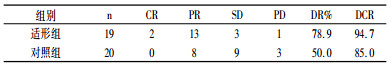
2 结果 2.1 疗效适形组和对照组的总有效率分别为78.9%和50.0% (P = 0.038)两组1年生存率分别为63% (12 /19)、50% (10 /20) %,2年生存率为26% (5 / 19)和10% (2 /20)。两组比较有统计学意义(P<0.05)。见表 2。
|
|
表 2 两组病例疗效观察 |
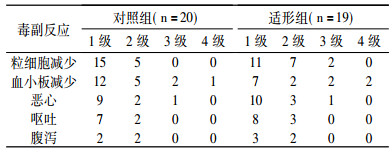
常见的毒副反应为粒细胞减少,其次为恶心、呕吐,限制毒性为血液毒性,见表 3。
|
|
表 3 两组病例毒副反应 |
单化组和适形组的CR和PR缓解率分别为23%、79%和9%、45%,差异有统计学意义(P = 0.01)。
3 讨论胰腺癌是缺乏血供的肿瘤,且胰腺周围重要脏器与解剖结构复杂,因此放疗在胰腺癌治疗中的地位常被忽视,随着三维适形放疗及调强放疗的开展,放化疗同时应用的优越性得到体现,尤其对于无法手术,局部进展期胰腺癌,中位生存期为8 ~ 10个月,而有远处转移者不到6个月[4],综合治疗可使局部区域肿瘤控制率和生存率达到最大化。
吉西他滨是一种脱氧胞苷的核苷类似物,能整合进DNA,具有放射增敏作用。机制与其能抑制核苷酸还原酶,进而导致细胞周期再分布进入S期,(消除G1期阻滞),并降低辐射导致凋亡阈值有关[5]。对于局部晚期胰腺癌,放疗期间同步化疗,能直接杀死肿瘤细胞,抑制致死性损伤、潜在性损伤的修复,促进周期细胞内的再分布、再氧合、再群体化,增加放疗敏感性。
常规放疗存在正常组织损伤大,因周围正常组织限制,不能有效提高肿瘤剂量。三维适形放疗为多焦点、非共面的照射,定位精确,使高剂量区的分布、形状与肿瘤靶区高度适合,且剂量在肿瘤边缘锐减,使肿瘤靶区的剂量可有效提高,而正常组织的受量在可控范围内,提高局控率[6],与此同时,适形组CA199缓解率明显优于单化组,提示放疗对控制原发灶有重要意义。
三维适形放疗联合吉西他滨化疗,与单药化疗相比,有效率分别为78.9%和50.0%,1、2 a生存率分别为63%、26%和50.0%、10%,有统计学意义,说明同步放化疗可改善患者的生存率,提高局控率。对于胰腺癌,我们仍需要早期干预、预防、发现、治疗,以提高胰腺癌患者的生活质量。
| [1] |
Jemal A, Siegel R, Ward E, et al. Cancer statistics 2009[J]. CA Cancer J Clin, 2009, 59(4): 225-249. DOI:10.3322/caac.20006 |
| [2] |
Parker SL, Tomg T, Bolden S, et al. Cancer statistics 2011[J]. CA Cancer J Clin, 1996, 46(1): 5-21. DOI:10.3322/canjclin.46.1.5 |
| [3] |
Gelibter A, Malaguti PD, Cosino S, et al. Fixed dose-rate gemcitabine infusion as first-line treatment for advanced-stage carcinoma of the pancreas and biliary tree[J]. Cancer, 2005, 104(6): 1237-1245. DOI:10.1002/(ISSN)1097-0142 |
| [4] |
Philip PA, Mooney M, Jaffe D, et al. Consensus report of the national cancer institute clinical trials planning meeting on pancreas Cancer treatment[J]. Clin Oncol, 2009, 27(33): 5660-5669. DOI:10.1200/JCO.2009.21.9022 |
| [5] |
Rosir JF, Beauduin M, Bruniaux M, et al. The effect of 2, -2, difluorodeoxycytidine (dFdC, gemcitabine) on radiation-induced cell lethality in two human head and neck squamous carcinoma cell line sdiffering in intrinsic radiosensitivty[J]. Int J Radiat Biol, 1999, 75(2): 245-251. DOI:10.1080/095530099140708 |
| [6] |
殷蔚伯, 余子豪. 消化系统肿瘤肿瘤放射治疗学[M]. 4版. 北京: 中国协和医科大学出版社, 2008: 149-151.
|