前列腺癌是一种男性常见的恶性肿瘤,近年在我国的发病率呈上升态势。目前的治疗方法包括:根治性切除术、体外放射治疗、放射性粒子植入治疗(永久性近距离治疗)、激素治疗和观察等[1]。三维治疗计划系统、直肠超声引导系统、会阴模板固定系统的出现将前列腺癌放射性粒子植入治疗技术推向了新的阶段,已成为前列腺癌的主要治疗手段之一。放射性粒子植入治疗在世界范围内迅速发展,由此带来的辐射防护问题越来越受重视,ICRP第98号出版物针对放射性粒子植入治疗前列腺癌的安全问题给出了若干指导建议,日本放射肿瘤治疗协会与泌尿学会于2003年公布了前列腺癌近距离治疗的安全使用指南,我国卫生部于2009年11月13日颁布了《放射性粒子植入治疗技术管理规范(试行) 》。本文就放射性粒子植入治疗前列腺癌辐射防护研究的新进展做一综述。
1 放射性粒子植入治疗前列腺癌放射性粒子植入治疗将放射性粒子按肿瘤的大小、形态植入肿瘤内或受肿瘤浸润侵犯的组织中,通过微型放射源释放持续、短距离的射线使肿瘤组织遭受最大程度的杀伤,正常组织不损伤或仅有微小损伤[2]。放射性粒子植入治疗早期局限性前列腺癌可达到与根治性切除术同样的治疗效果,放射性粒子植入配合体外照射或激素治疗中、晚期前列腺癌也可取得相当好的疗效[3, 4]。与体外放射治疗相比,放射性粒子植入治疗病灶局部剂量高,剂量分布更适于肿瘤的大小和形状,对周围正常组织(直肠、膀胱)损伤小,具有安全、微创、并发症发生率低等优势[5]。
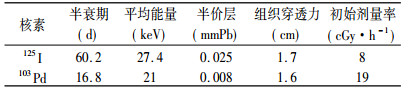
放射性粒子植入治疗前列腺癌使用的放射性核素主要是125I和103Pd,其物理特性如表 1。核素的选择主要决定于Gleason分级,低到中级(2 ~ 6)选择125I; 5 ~ 7级,两种核素均可; 高级(7 ~ 10)选择103Pd。单纯植入125I或103Pd粒子,处方剂量为144Gy和115Gy[1],植入125I粒子的总活度在6.18 × 108 ~ 1.76 × 109Bq(16.2 ~ 47.6mCi)范围,植入103Pd粒子的总活度在2.23 × 109 ~ 6.89 × 109Bq(58.8 ~ 186.3mCi)范围。它们属于低能放射源,在组织中的剂量分布有几何学下降的特点,在植入粒子周围的正常组织有陡峭的剂量坡度分布[6]。
|
|
表 1 放射性核素的物理特性 |
放射性粒子植入治疗前列腺癌需要泌尿外科医生、超声科医生、放射技师、物理师、麻醉师、护士等多人密切配合完成。术中,医务人员可能暴露于放射性粒子释放的低能光子和C -型臂产生的散射X射线,需采取有效的个人防护措施(铅衣、铅帽、铅围脖、铅手套等)。放射工作人员连续5a的年平均有效剂量不得超过20mSv,任何一年的有效剂量不得超过50mSv; 四肢(手和足)或皮肤的年当量剂量不得超过500mSv。
Anglesio等[7]报道,125I粒子植入治疗患者前方体表的平均空气比释动能率为55μGy·h-1; 外科医生一次手术手部的平均当量剂量为420μSv,经铅手套屏蔽后约降低80%;技术人员一次手术手部的平均当量剂量为65μSv; 外科医生的平均有效剂量小于30μSv,铅围裙起了很好的防护作用。Schiefer等[8]报道,有经验的外科医生一次手术平均用时19.2min,食指和手背的平均当量剂量为1.31mSv和0.61mSv; 而无经验的外科医生则需要34.8min,吸收剂量也分别增加到2.07mSv和1.05mSv,手术的熟练程度是影响外科医生吸收剂量的重要因素。在人工向前列腺植入放射性粒子的过程中,引导植入针的指尖皮肤明显吸收了最大剂量,限制了外科医生实施手术的次数。外科医生手指的吸收剂量有一半以上来自于透视产生的散射X射线; 与应用植入针的数量和操作时间有一定的相关性,与植入粒子的总活度无关,主要受按压区域粒子影响。Fujii等[9]报道,一次125I粒子植入手术后,外科医生左手和左臂的表面剂量明显高于其他部位。无铅手套防护,左手背表面剂量最高为650μGy,左上臂表面剂量最高为328μGy,左掌表面剂量最高为204μGy; 有0.03mm铅手套防护,左手背的表面剂量要比左前臂低50% ~ 80%。外科医生手部的表面剂量取决于植入粒子的数目和透视参数,透视管电压对外科医生左手和左臂的表面剂量产生较大影响。外科医生0.25mm铅衣内各处表面剂量均小于100μGy,铅衣外胸部和腹部的平均表面剂量为101μGy和143μGy,在铅衣的屏蔽下分别降为原来的为10 %和9 %; 助理医生的局部表面剂量最大为97μGy(右掌); 其他人员的局部表面剂量均小于10μGy。
全国职业照射个人剂量监测与评价学术研讨会报道,1996 ~ 2000年,我国放射治疗人员的平均年有效剂量为0.97mSv; 2005年,法国、德国、爱尔兰放射治疗人员的平均年有效剂量在2 ~ 8mSv之间,有个别人年有效剂量大于50mSv[10]。目前,关于监测实施近距离治疗的外科医生手部皮肤当量剂量的报道很少[10, 11]。
3 辐射剂量监测及影响因素美国核管制委员会(NRC)建议医疗机构应当给予患者辐射防护指导,以避免放射性粒子植入治疗对其家庭成员或公众造成不必要的危害。Anglesio指出,评估屏蔽的需要与否和提供合理的辐射防护建议,应当核实患者周围的剂量当量率。
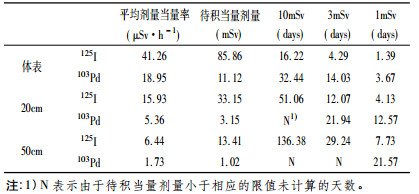
Smathers等[12]总结了美国华盛顿大学38例典型125I或103Pd粒子治疗前列腺癌患者的辐射暴露数据,植入125I粒子或103Pd粒子患者骨盆处前方体表平均剂量当量率分别为50μSv· h-1和17μSv·h-1,侧方体表剂量当量率则远低于前方,所有患者距离皮肤100cm处的剂量当量率均在0.3μSv·h-1以下。Kono等[13]报道了17例125I粒子治疗前列腺癌患者骨盆处前方、两侧体表及周围的辐射暴露情况,前方体表 4.5cm处平均剂量当量率为67.1μSv·h-1,20cm处平均剂量当量率为19.0 μSv·h-1,50cm处平均剂量当量率为5.0μSv·h-1,100cm处平均剂量当量率为1.4μSv·h-1,左、右侧体表 4.5cm处平均剂量当量率分别为4.2μSv·h-1和3.9μSv·h-1,远处的平均剂量当量率则更低,略高于本底水平,两项研究同样得出了患者前方剂量当量率与植入粒子总活度呈一定正相关的结论,Kono推测患者两侧的平均剂量当量率低可能与髋关节骨的辐射衰减作用有关。Cattani等[14]报道了216例前列腺癌患者放射性粒子植入术后一天的辐射剂量监测情况,患者臀部体表、20cm和50cm处的平均剂量当量率,如表 2。研究明确了患者周围辐射剂量率与粒子总活度和组织厚度间的相关性,患者植入125I粒子的总活度越大,体表和皮肤20cm处的剂量当量率越高; 组织厚度或患者体质指数越大,单位活度的臀部体表剂量当量率越低。
|
|
表 2 患者周围辐射剂量监测数据 |
此外,Gagna等[15]报道的6例125I粒子植入治疗前列腺癌患者术后会阴部体表剂量当量率大约为170μSv·h-1; 与其它研究比较,这一剂量当量率水平较高。1995年1月~ 2008年7月接受125I或103Pd粒子植入治疗的1 279例T1-2期前列腺癌患者术后周围的剂量当量率测量结果显示,125I粒子或103Pd粒子治疗患者前方体表 30cm处的平均空气比释动能率分别为4.9μGy·h-1和1.5μGy·h-1[16],基于大样本量的辐射剂量监测数据更具有实际意义。
4 周围人群辐射暴露与防护美国核管制委员会(NRC)条例规定:放射性粒子植入治疗患者接触的家庭成员、陪护者或探视者暴露的年有效剂量不得超过5mSv,公众的年有效剂量不得超过1mSv。国家标准GB18871-2002《电离辐射防护与辐射源安全基本标准》规定:公众照射的剂量限值不适用于患者的慰问者,但是,应对患者的慰问者所受的照射加以约束,使他们在患者诊断或治疗期间所受的剂量不超过5mSv,应将探视摄入放射性物质的患者的儿童所受的剂量限制于1mSv以下。
Michalski等[17]利用热释光剂量计对放射性粒子植入治疗前列腺癌患者配偶、其他家庭成员、住所房间的吸收剂量进行监测,三周后的结果显示,植入125I粒子或103Pd粒子患者配偶的平均有效剂量分别为0.10mSv、0.02mSv,其他家庭成员的平均有效剂量分别为0.07 mSv、0.02mSv,大多数房间的剂量当量值处于本底水平。Cattani等[14]计算了植入125 I粒子或103 Pd粒子前列腺癌患者臀部体表、20cm处、50cm处家庭成员和公众有效剂量分别达到3mSv和1mSv限值所需要的时间(意大利,居留因子为1),如表 2; 上述结果对家庭成员和公众的吸收剂量估计过高,接触者不大可能24h停留在剂量当量率最大的某一位置。从Michalski等的研究可以看出,与放射性粒子植入治疗前列腺癌患者接触的家庭成员、亲属、公众的辐射暴露都处在比较低的水平,但在放射性粒子植入初几周内,保持与患者的距离、减少与患者亲密接触时间都尤为重要; 患者应该采取措施,尽量减少家庭成员(尤其是孕妇和儿童)的辐射暴露; Cattani建议对于妻子怀孕期内进行放射性粒子植入的患者使用103Pd粒子进行治疗以减少妻子和胎儿的吸收剂量。Kaulich等[18]报道,无防护条件下,距离125 I粒子植入治疗前列腺癌患者体表 50cm处家庭成员的年有效剂量将达到4.3mSv,个人剂量达到1.0mSv仅需22d(剂量当量率为6.4μSv /h,居留因子为1 /3)。患者在术后一段时间穿着Χ射线防护短裤能够有效减少家庭成员的辐射暴露,经计算,125I粒子植入治疗患者术后立即穿着0.17mmPb Χ射线防护短裤和15d后穿着0.17mmPb Χ射线防护短裤两种情形下,使距离患者体表 50cm处家庭成员的年有效剂量从4.3mSv下降到1.0mSv需要的穿着时间分别是127d和217d(剂量当量率为6.4μSv /h,居留因子为1 /3),如果患者穿着Χ射线防护短裤的时间点被延迟,将错过辐射防护的最佳时机。
针对极少发生的放射性粒子的意外排出情况,ICRP在第98号出版物中指出要注意以下几点: ①医学观察期内对患者尿液进行过滤处理,使用厕所的排污管道应能够提供足够的低能光子防护; ②2 ~ 3周内性接触,患者应使用避孕套; ③不得用手触碰发现的放射性粒子源。国家职业卫生标准GBZ178-2006 《低能γ射线粒子源植入治疗的放射防护与质量控制检测规范》在此方面也做了明确规定。如125I粒子植入12个月内或103Pd粒子植入3个月内患者死亡,ICRP建议:从死体中移除前列腺; 火葬场工作人员使用防护手套和呼吸防护用具以减少潜在的意外摄入和吸入; 病人的骨灰应保存在密封的金属盒内距粒子植入时间至少一年,在10个半衰期后分散到周围环境中去。
5 结束语放射性粒子植入治疗前列腺癌辐射防护的研究资料主要集中在剂量监测、剂量估算和防护措施等方面,对患者接触人群的辐射流行病学研究很少见。尽管如此,经过各国学者近十余年来的努力,人们对放射性粒子植入治疗前列腺癌辐射暴露的认识已经有了显著提高。相关的研究证实,防护管理得当,放射性粒子植入治疗前列腺癌对职业人员、患者家属、公众来讲是相对安全的。但从辐射防护最优化的角度出发,职业人员应当严格遵守临床操作规范,给予患者正确的辐射安全指导,保护患者家庭成员和公众免遭不必要的辐射危害,避免不必要的辐射恐慌。
| [1] |
Nag S, Beyer D, Friedland J, et al. American brachytherapy society recommendations for transperineal permanent brachytherapy of prostate cancer[J]. Int J Radiation Oncology Biol Phys, 1999, 44(4): 789-799. DOI:10.1016/S0360-3016(99)00069-3 |
| [2] |
卓水清, 陈林, 张福君, 等. 125I放射性粒子植入术后患者周围辐射剂量的监测[J]. 癌症, 2007, 26(6): 666-668. |
| [3] |
刘利维, 韩端发, 刘春雨, 等. 近距离放射疗法与前列腺根治切除治疗局限性前列腺癌的疗效比较-meta分析[J]. 现代泌尿外科杂志, 2008, 13(4): 288-290. DOI:10.3969/j.issn.1009-8291.2008.04.014 |
| [4] |
Sylvester JE, Grimm PD, Blasko JC, et al. 15-Year biochemical relapse free survival in clinical stage T1-T3 prostate cancer following combined external beam radiotherapy and brachytherapy:seattle experience[J]. Int J Radiation Oncology Biol Phys, 2007, 67(1): 57-64. DOI:10.1016/j.ijrobp.2006.07.1382 |
| [5] |
王俊杰, 黄毅, 冉维强, 等. 125I粒子近距离治疗前列腺癌临床应用[J]. 中华放射医学与防护杂志, 2004, 24(6): 509-512. DOI:10.3760/cma.j.issn.0254-5098.2004.06.009 |
| [6] |
Herstein A, Wallner K, Merrick G, et al. I-125 versus Pd- 103 for low-risk prostate cancer:long-term morbidity outcomes from a prospective randomized multicenter controlled trial[J]. Cancer Journal, 2005, 11(5): 385-389. DOI:10.1097/00130404-200509000-00005 |
| [7] |
Anglesio S, Calamia E, Fiandra C, et al. Prostate brachytherapy with iodine-125 seeds:radiation protection issues[J]. Tumori, 2005, 91(4): 335-338. |
| [8] |
Schiefer H, Toggenburg FV, Seelentag W, et al. Exposure of treating physician to radiation during prostate brachytherapy using iodine-125 seeds[J]. Strahlentherapie und Onkologie, 2009, 185(10): 689-695. DOI:10.1007/s00066-009-1990-z |
| [9] |
Fujii K, Ko S, Nako Y, et al. Dose measurement for medical staff with glass dosemeters and thermoluminescence dosemeters during 125I brachytherapy for prostate cancer[J]. Radiation Protection Dosimetry, 2011, 144(1-4): 459-463. DOI:10.1093/rpd/ncq572 |
| [10] |
Donadille L, Carinou E, Ginjaume M, et al. An overview of the use of extremity dosemeters in some European countries for medical applications[J]. Radiation Protection Dosimetry, 2008, 131(1): 62-66. DOI:10.1093/rpd/ncn229 |
| [11] |
Vanhavere F, Carinou E, Donadille L, et al. An overview on extremity dosimetry in medical applications[J]. Radiation Protection Dosimetry, 2008, 129(1-3): 350-355. DOI:10.1093/rpd/ncn149 |
| [12] |
Smathers S, Wallner K, Korssjoen T, et al. Radiation safety parameters following prostate brachytherapy[J]. Int J Radiation Oncology Biol Phys, 1999, 45(2): 397-399. DOI:10.1016/S0360-3016(99)00168-6 |
| [13] |
Kono Y, Miyamoto Y, Oohashi S, et al. Radiation exposure to general public after permanent brachytherapy for prostate cancer[J]. Radiation Protection Dosimetry, 2011, 146(1-3): 229-230. DOI:10.1093/rpd/ncr156 |
| [14] |
Cattani F, Vavassori A, Polo A, et al. Radiation exposure after permanent prostate brachytherapy[J]. Radiotherapy and Oncology, 2006, 79: 65-69. DOI:10.1016/j.radonc.2006.02.010 |
| [15] |
Gagna G, Gauron C, Amabile JC, et al. Radiation exposure to operating room staff during prostate brachytherapy using iodine -125 seeds[J]. Radioprotection, 2011, 46(2): 189-208. DOI:10.1051/radiopro/2011103 |
| [16] |
Dauer LT, Kollmeier MA, Williamson MJ, et al. Less-restrictive, patient-specific Radiation safety precautions can be safely prescribed after permanent seed implantation[J]. Brachytherapy, 2010, 9(2): 101-111. DOI:10.1016/j.brachy.2009.06.006 |
| [17] |
Michalski J, Mutic S, Eichling J, et al. Radiation exposure to family and household members after prostate brachytherapy[J]. Int J Radiation Oncology Biol Phys, 2003, 56(3): 764-768. DOI:10.1016/S0360-3016(03)00002-6 |
| [18] |
Kaulich TW, Bamberg M. Radiation protection of persons living close to patients with radioactive implants[J]. Strahlentherapie und Onkologie, 2010, 186: 107-112. DOI:10.1007/s00066-010-2073-x |