核潜艇是我国海军重要的战略军事力量, 对我海军战斗力有重要意义, 核潜艇出航任务具有时间长、航程远、海情复杂等特点, 艇员长期处在相对密封的特殊环境, 长期接触微量放射性、电离辐射、高温、有害气体等, 常出现免疫力下降、免疫功能异常等情况。本研究拟通过对淋巴细胞免疫功能在长航前后的变化进行研究, 了解环境因素对机体免疫系统的影响, 为提高艇员对环境损害及各种疾病的防御能力提供新的理论依据。
1 材料与和方法 1.1 对象随机选取的某部核潜艇艇员35名, 出航时间均> 30d, 平均年龄为(27.5 ± 1.9)岁, 均为男性。于出航前1天上午7:00时和返航后次日上午7:00时坐位抽取肘静脉血。
1.2 主要试剂与仪器淋巴细胞分离液(军事医学科学院提供), T克隆体系(军事医学科学院提供), 96孔细胞培养板(丹麦NUNC公司), 超净工作台(北京冠鹏锦华设备有限公司), 倒置相差显微镜(Olympus公司, 日本)。AnnexinV-FITC细胞凋亡试剂盒(Boehringer Mannheim公司德国); 流式细胞仪(Becten Dickinson公司美国)。
1.3 长航前后白细胞总数和淋巴细胞总数的检测静脉血2ml注入含7.5% EDTA二钠20μl的试管中, 并于抽血后2h内进行指标检测。采用日本Sysmex XT-1800i全自动五分类血液分析仪检测淋巴细胞数。
1.4 长航前后T淋巴细胞集落形成数的检测静脉血5ml注入含7.5% EDTA二钠50μl的试管中, 加3ml 1 640培养液混匀后沿试管壁缓慢加到淋巴细胞分离液上, 4℃ 1 700rpm离心15min, 收集中间呈絮状的淋巴细胞, 加入1 640培养液8ml洗涤, 1 500rpm离心15min, 去上清, 再加入1640培养液8ml洗涤, 1 000rpm离心10min, 去上清, 加入1 640培养液, 调整细胞的浓度至2.0x106/ml; 将细胞悬液0.1ml加入到0.9ml的T克隆体系中, 充分吹打混匀后取0.4ml平均分配到细胞培养板的4个孔中(此时每孔中的细胞数为2.0 × 104), 置于37℃, 5%的CO2孵箱中培养7d。倒置显微镜下原位计数, 以大于40个细胞以上的细胞团计数集落。
1.5 长航前后淋巴细胞凋亡率的检测淋巴细胞分离方法同前, 调整细胞的浓度至2.0 × 106/ml, 凋亡检测按AnnexinV- FITC细胞凋亡试剂盒说明书步骤严格进行。流式细胞仪检测AnnexinV-FITC为绿色荧光, PI为红色荧光。结果以细胞百分比计算。
1.6 统计学处理用SPSS11.0对数据进行统计学处理, 检测结果以x±s表示, 组间比较用t检验。
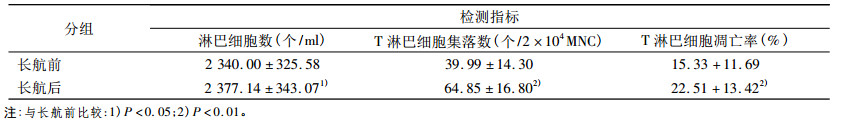
2 结果长航前后淋巴细胞免疫活必比较, 具体见表 1。核潜艇艇员长航前后淋巴细胞总数比较得出, 长航后, 核潜艇艇员外周血淋巴细胞数较长航前明显增多(P < 0.05)。核潜艇艇员长航前后T淋巴细胞集落数的比较得出, 长航后外周血T淋巴细胞集落形成能力较长航前显著升高(P < 0.01)。长航前后T淋巴细胞凋亡率的比较得出, 长航后艇员外周血T细胞凋亡率较长航前显著增高(P < 0.01)。
|
|
表 1 长航前后淋巴细胞免疫活性比较(x±s, n=35) |
潜艇舱室环境密闭, 工作生活空间狭小, 舱室环境因素极为复杂, 仅可能引起机体损害的有害气体就达到68种[1], 同时还有电磁辐射、噪声、震动等多种有害环境因素, 而核潜艇舱室区别于常规潜艇, 持续存在有微量核辐射[2], 这些有害因素可能对官兵的健康产生潜在危害。本实验研究了长航前后T淋巴细胞集落形成能力、T淋巴细胞凋亡率及外周血淋巴细胞数等变化, 探讨核潜艇复杂环境因素, 尤其是微量核辐射对免疫系统, 特别是淋巴细胞功能的影响。
有研究发现核潜艇艇员外周血粒细胞数量及功能在长航前后发生显著下降, 并认为这一变化主要是舱室内微量的核辐射导致的[3]。本研究则发现, 长航后艇员外周血淋巴细胞数反而增多, 且T淋巴细胞集落(TL-CFU)形成能力亦显著提高。有集落形成能力的T淋巴细胞主要是CD4+T淋巴细胞, 说明长航后外周血活化的CD4+T细胞数量增多, CD4+T辅助细胞活化是细胞免疫应答启动的重要环节, 其分泌的细胞因子能加快淋巴细胞成熟及释放[4], 这可能是促进外周血淋巴细胞数量增加的重要原因, 这些改变均提示长航后机体对免疫应答强度发生上调, CD4+T辅助细胞活化后可诱导一系列复杂免疫反应, 如可分泌多种细胞因子[5]; 介导炎症反应; 辅助B淋巴细胞产生免疫球蛋白; 诱导淋巴细胞分化成熟; 激活巨噬细胞、中性粒细胞等, 从而使机体对刺激因素的敏感性增强, 反应强度亦增高[6]。我们认为淋巴细胞数量及功能改变可能与舱室内微量核辐射的作用有关, 微小剂量的核辐射可激活淋巴细胞的活性, 累计照射量小于0.1Gy时, T细胞活性随着辐射累计逐渐增加, 0.1 Gy时被最大程度激活, 故舱室内的微量核辐射可能CD4+T活化的主要原因, 但当累计照射剂量进一步升高, 淋巴细胞活性则出现明显的抑制[7]。
本研究发现长航后外周血淋巴细胞数量增多, 但同时外周血T淋巴细胞凋亡率也明显上升, 提示长航后T淋巴细胞寿命缩短, 凋亡倾向增高。T淋巴细胞凋亡过程受到凋亡蛋白的调控, 主要凋亡蛋白包括:抗细胞凋亡蛋白(包括bcl-2、bag-1、bcl-XL等)和诱导凋亡蛋白(包括bax、bad、bcl-XS等)[8]。抗细胞凋亡蛋白基因高表达可阻遏细胞凋亡, 延长细胞寿命; 诱导凋亡蛋白的基因是bc1-2的同源基因, bcl-2家族的前凋亡蛋白, 并作为一种细胞损伤和刺激的传感器, 对抗在正常状态下抗凋亡蛋白的功能, 拮抗其保护效应而使细胞趋于凋亡[9]。长航后淋巴细胞凋亡率升高, 可能与外界环境影响淋巴细胞内这组同源凋亡相关蛋白的表达平衡有关, 当细胞受到微量核辐射侵袭, 可产生DNA损伤, 因编码抗细胞凋亡蛋白的基因片段对辐射损伤的敏感性高于诱导凋亡蛋白基因片段, 故两者间的基因转录的平衡被打破, 诱导凋亡蛋白基因表达增强, bax等诱导凋亡蛋白可定位于线粒体表面并破坏线粒体通透性, 从而激活凋亡程序, T淋巴细胞凋亡速度加快[10]。在这一过程中, 微量辐射可能是引起DNA损伤的主要因素, 而有害气体、电离辐射、微波、电磁波等其他外源性损伤因素可能也参与其中, 并作用于淋巴细胞凋亡程序, 最终造成外周血T淋巴细胞凋亡率升高。
长航后, 艇员外周血淋巴细胞总数及CD4+T辅助淋巴细胞数虽明显上调, 但由于免疫效应细胞如粒细胞、巨噬细胞等数量和功能受舱室内多种环境因素的影响而下降, 其趋化、粘附、吞噬及分泌等功能均受影响, 故艇员整体免疫力仍然呈现一个下降的趋势[11], 易罹患各种疾病。同时, CD4+T辅助淋巴诱导的机体免疫应答强度增高可诱发过度的炎症反应, 产生大量炎症刺激因子, 加重组织炎症反应及损伤, 淋巴细胞在过度的炎症反应中被大量激活进入外周血并消耗[12], 可能也是外周血中淋巴细胞数量增加、但寿命缩短、凋亡率升高的原因。此外, 长航期间IL-2、IL-8和TNF-α等细胞因子含量的改变, 也可造成机体整体免疫状态与免疫水平的变化, 对淋巴细胞的活性及数量产生影响[13]。长航期间与外界环境的隔绝, 可造成生理及心理的复杂应激反应, 对机体的细胞免疫与体液免疫均可产生影响[14]。这是一个复杂的调控过程, 其中的机制有待进一步研究阐明。
T淋巴细胞是机体免疫能力的标志性指标, 本研究显示, 长航后机体免疫应答强度上调, T淋巴细胞凋亡率升高, 提示长航时舱室内微量核辐射可影响艇员机体免疫力。因此, 严密监控和防护艇内有各种有害物质, 尤其加强核辐射的防护对保护艇员的身体健康具有重要意义。
| [1] |
许林军, 施莼, 刘洪林, 等. 潜艇舱室空气污染与控制措施初探[J]. 海军医学杂志, 2002, 23(4): 302. DOI:10.3969/j.issn.1009-0754.2002.04.006 |
| [2] |
李雨. 俄罗斯核动力舰船作业时对电离辐射的防护监督[J]. 中国辐射卫生, 2009, 18(3): 341-344. |
| [3] |
禹华伟, 梁冰, 徐大韬, 等. 核潜艇长航对艇员外周血粒细胞系的影响[J]. 实用医药杂志, 2007, 24(4): 468-469. DOI:10.3969/j.issn.1671-4008.2007.04.055 |
| [4] |
Brusko TM, Putnam AL, Bluestone JA. Human regulatory T cells:role in autoimmune disease and therapeutic opportunities[J]. Immunol Rev, 2008(223): 371-390. |
| [5] |
周洲, 冯娟, 王宪. 调节性T细胞的分化及其影响因素[J]. 生物物理学报, 2012, 28(2): 93-111. |
| [6] |
Taylor A, Verhagen J, Blaser K, et al. Mechanisms of immune suppression by interleukin-10 and transforming growth factor-b:the role of T regulatory cells[J]. Immunology, 2006, 117: 433-442. DOI:10.1111/imm.2006.117.issue-4 |
| [7] |
刘伟宏, 刘树铮. 单次X线全身照射后小鼠免疫学参数剂量效应关系[J]. 中华放射医学与防护杂志, 1990(10): 2. |
| [8] |
Guo B, Zhai D, Cabezas E, et al. Humanin peptide suppresses apoptosis by interfering with Bax activation[J]. Nature, 2003, 423(6938): 456-461. DOI:10.1038/nature01627 |
| [9] |
Viktorsson K, Ekedahl J, Lindebro MC, et al. Defective stresskinase and Bak activation in response to ionizing radiation but not cisplatin in a non-small cell lung carcinoma cell line[J]. Exp Cell Res, 2003, 289(2): 256-258. DOI:10.1016/S0014-4827(03)00264-7 |
| [10] |
Liu SZ. Cellular and molecular changes induced by low-versus high-dose radiationn:Burkart W.High level of natural radiation and radon areas:Radiat ion dose and health effects[J]. Am sterdam:Elservier, 2002, 179-188. |
| [11] |
Myznikov IL, Marchenko VV, Mik BA. Functional status and seasonal changes in white blood cells in submarine personnel in the Kola Polar region[J]. Aviakosm Ekolog Med, 2003, 37(1): 57-60. |
| [12] |
Pallandre JR, Brillard E, Crehange G, et al. Role of stat3 in cd4+, cd25+, foxp3+regulatory lymphocyte generation:Implications in graft-versus-host disease and antitumor immunity[J]. Immunol, 2007, 179(11): 7593-7604. DOI:10.4049/jimmunol.179.11.7593 |
| [13] |
周洲, 冯娟, 王宪. 调节性T细胞的分化及其影响因素[J]. 生物物理学报, 2012, 28(2): 93-111. |
| [14] |
程传苗, 李兆申, 黄文, 等. 军事应激对军人心理和免疫内分泌系统的影响[J]. 解放军医学杂志, 2007, 32(3): 189-190. DOI:10.3321/j.issn:0577-7402.2007.03.004 |