2. 山东大学第二医院肿瘤防治中心;
3. 山东省医学科学院放射医学研究所, 山东 济南 250062
经过半个多世纪的发展, 辐射生物剂量学已经取得了长足的进步。目前能够用于估算受照剂量的生物指标有多种, 但其中仍然以外周血淋巴细胞染色体畸变分析最为稳定和可靠。然而用常规的细胞遗传学方法, 染色体仅在细胞有丝分裂中期才能见到, 人血淋巴细胞要用PHA刺激培养2天, 才能进行畸变观察。因此, 当在事故情况下, 无法在短时间内提供剂量。早熟染色体凝集技术克服了常规技术的不足成为辐射生物剂量学研究的新方向。随着PCC技术的不断发展和完善, 它通过使用一些促细胞分裂剂及磷酸酶抑制剂刺激外周血淋巴细胞, 取代了过去传统PCC中细胞杂交技术, 使PCC产额大大增加, 显示出了用于辐射生物学剂量的广泛前景[1]。因此早熟染色体凝集的畸变分析做为生物剂量计的研究开始倍受瞩目。我们利用花萼海绵体诱癌素A (CalyculinA)诱导PCC, 以观察到的G1、G2/M期淋巴细胞的断片、双着丝粒体和着丝粒环作为生物指标, 探讨CalyculinA诱导早熟染色体凝集技术作为低剂量电离辐射生物剂量计的可行性, 并拟合了剂量-效应曲线。以期为早熟染色体凝集的畸变分析做为低剂量受照情况下的生物剂量计使用提供一些理论数据。
1 材料与方法 1.1 主要试剂Calyculin A购自美国SIGMA公司, RPMI 1640培养基系美国GIBCO BRL公司产品。优级新生牛血清购于中美合资兰州民海生物工程有限公司, 植物血凝素(PHA)购自广州市医药工业研究所, HEPES购自北京Solarbio公司, 秋水仙素购自英国Cambia公司。L-谷氨酰胺购于上海国药集团化学试剂有限公司。
1.2 血液样品血样采自3名健康成人(知情同意), 年龄30岁左右, 无烟酒嗜好及慢性病史, 半年内未进行过任何放射性医学诊断或治疗, 无细胞毒药物接触史。每人取血各约5ml, 肝素抗凝后分装于0.5ml的无菌EP管中, 不留空气后密封。将血样分为3组, 每组拟定6个照射剂量点。
1.3 照射条件用Elekta Synergy医用直线加速器(由山东大学第二附属医院放疗科提供)进行全血样品的X射线照射, 能量为6MeV, 源皮距100cm, 照射野为24cm × 24cm, 剂量率为400Mu/min。照射在室温下进行, 将EP管放入固体水的插孔中, 根据TPS计算出Mu, 拟定照射剂量分别为0、0.1、0.25、0.5、0.75和1.0Gy。
1.4 细胞培养、收获和制片将照射后的全血0.5ml接种于预先配置好的4.5mlRPMI 1640培养基(含20%新生牛血清、0.2mg/mLPHA、20mmol/L HEPES、2mmol/L的L-谷氨酰胺)中, 于37℃、5% CO2恒温培养箱内培养24h后, 加入秋水仙素, 使其终浓度为0.03μg/ml, 继续培养至46h后加入Calyculin A (Sigma, USA), 使其终浓度达40nmol/L, 再培养2h收获淋巴细胞。收获的细胞先用0.075mol/L KCl低渗液在37℃水浴条件下低渗20min, 预固定后立即离心, 用甲醇:冰醋酸(3:1)固定两次, 冰片滴片。湿热条件下使淋巴细胞和染色体均匀散开, 经空气干燥后用10% Giemsa染液染色15min。
1.5 阅片采用盲法阅片, 在油镜下选择细胞完整、染色体形态清晰且铺展良好的细胞进行分析, 每个剂量点分析1 000个G1、G2/M-PCC细胞, 计数各剂量组染色体畸变数, 在显微镜下观察时, 典型的G1期分裂相为46对染色体单体, 数目超过46对的部分计为断片数。典型的G2/M期分裂相为46条染色体, 因均经历了S期, DNA已经完成了复制, 故每条染色体有两条染色单体组成, G2期与M期分裂相很难明确区分, 判断断片的标准与常规染色体畸变分析法相同。同时计数G1、G2/M期的双着丝粒体+着丝粒环数, 所有畸变均有两名观察者进行审核。
1.6 统计学处理数据以x±s表示, 应用SPSS16.0统计软件包进行统计分析。采用WHO提供的3种数学模式对实验数据做曲线拟合, 通过检验回归系数的显著性和曲线的拟合度确定拟合曲线。P < 0.01为差异有统计学意义。
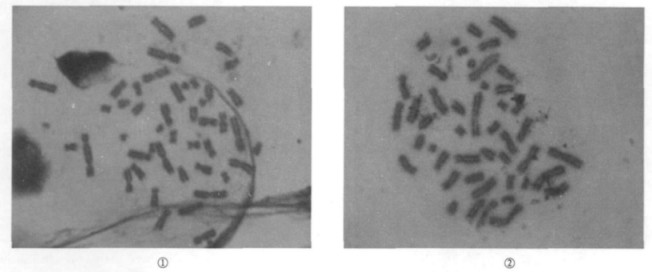
2 结果 2.1 染色体畸变辐射造成染色体不稳定性畸变, 包括无着丝粒断片(ace)、双着丝粒(dic)和着丝粒环(r)见图 1。
|
图 1 淋巴细胞染色体图片(× 100倍) 注:①:细胞中可见1个双着丝粒染色体(dic);②细胞中可见1个着丝环(r) |
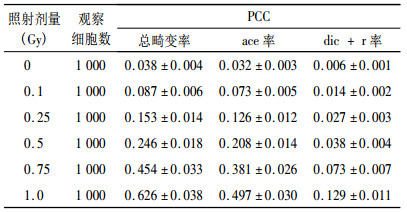
由表 1结果可以看出, 随着照射剂量的增加, PCC总畸变数、PCC断片数、双着丝粒体加环状染色体数量逐渐增加, 呈现出明显的剂量效应关系。
|
|
表 1 不同剂量X射线照射后诱发的PCC畸变率(x±s) |
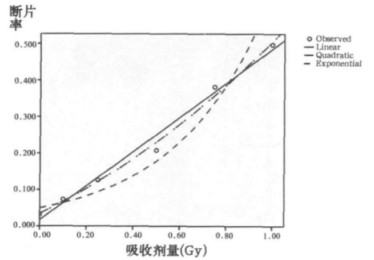
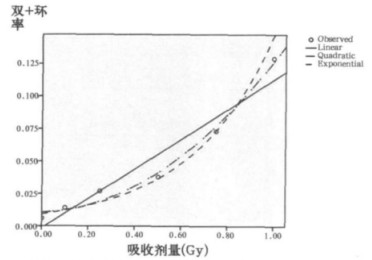
根据表 1的统计结果, 用SPSS16.0软件拟合剂量效应的回归方程, 计算方程拟合度(R2), 检验回归系数的显著性。结果表明, 在0~1.0Gy剂量范围内, 断片率、双着丝粒体+着丝粒环率、总畸变率拟合的最佳数学模式, 均为二次多项式y=a+bD+cD2, (其中y为畸变数/细胞或畸变率, D为照射剂量)。各回归方程的回归系数检验, P值均小于0.01, 表明回归方程成立。结果见表 2。拟合曲线见图 2~图 4。
|
|
表 2 不同照射剂量诱发染色体畸变的辐射剂量-效应曲线回归方程式、回归系数和拟合度检验 |

|
图 2 X射线照射后PCC总畸变率拟合的曲线 |
|
图 3 X射线照射后PCC断片率拟合的曲线 |
|
图 4 X射线照射后PCC双+环率拟合的曲线 |
CalyculinA是一种特殊的Ⅰ型和2A型蛋白磷酸酶抑制剂, 可诱导外周血淋巴细胞在细胞周期的各时相发生早熟染色体凝集。CalyculinA诱导早熟染色体凝集的方法与传统的秋水仙素阻断法相比可以获得较高的有丝分裂指数, 因此更加容易建立剂量效应曲线[2]。当细胞受到电离辐射时大多数滞留在G2期而不能进入有丝分裂阶段, 用传统的秋水仙素阻断法很难甚至不能获得足够的用于分析的中期时相的染色体, 正是由于calyculinA法可以诱导受到γ射线照射处于严重损害的间期染色体发生凝集[3], 降低了染色体畸变修复或丢失的机会, 因此它对电离辐射的灵敏度高于常规染色体分析法。
随着电离辐射技术的广泛使用, 长期小剂量、低剂量率的职业受照所引起的各种生物效应也越来越受到人们的关注。电离辐射可以通过直接损伤DNA或通过产生自由基间接损伤DNA, 从而引起DNA的断裂, 在核型分析中出现染色体缺失和染色体断片; 断裂的染色体经过修复可以重新连接, 如果连接正确, 则染色体恢复正常, 如果连接错误, 则可能出现染色体易位、双着丝粒和环状染色体等异常形态。本研究结果表明, 离体外周血接受低LET的X射线的照射后产生的染色体畸变类型以无着丝粒断片为主。符合小剂量低剂量率照射所致的畸变特点。与Kawata等[4]报道相一致。
离体血建立染色体畸变剂量-效应曲线用于事故受照者的剂量估算已取得较好的效果。国内外一些学者分别用X射线、γ射线等照射健康离体人血, 证明在一定剂量范围内染色体畸变率和受照剂量间有良好的线性关系, 并拟合回归方程用来估算受照人员的生物剂量[5-7]。但所开展的工作大多是针对受较大剂量照射的情况, 然而在现实生活中职业受照人员主要是受到低剂量的电离辐射, 宇航员在太空中受到的宇宙射线也主要是低剂量辐射。因此更需建立低剂量照射的剂量-效应曲线和规范早熟凝集染色体畸变率的检测方法。于是, 本实验室用0~1Gy的X射线照射离体血, 人为造成细胞损伤, 诱导细胞的染色体发生畸变。然后, 应用Calyculin A诱导PCC的方法检测不同剂量的X射线诱发的染色体总畸变率、断片率、双着丝粒体加着丝粒环率, 建立了染色体畸变率剂量-效应曲线。结果表明, 在0~1Gy的剂量范围内, 淋巴细胞染色体畸变与受照剂量呈正相关, 与先前报道相符[8]。通过剂量-效应曲线回归方程的方差分析(F检验)和剂量-效应曲线拟合度相关指数检验, 证实本实验所建立的染色体畸变率的回归系数有较高的统计学意义(P < 0.01), 且曲线的拟合度良好(R2接近1)。因此本实验所建立的染色体畸变率的回归曲线成立。考虑到低传能线密度(LET)辐射诱发的染色体畸变存在剂量率效应[9], 当估算不同剂量率照射的事故病人吸收剂量时, 如果采用同一剂量率的剂量-效应曲线估算, 结果会有误差, 尤其在剂量率相差较大时, 误差甚至会很大, 为了解决这一问题需要分别拟合高、中、低不同剂量率的剂量-效应曲线, 以便准确估算不同剂量率受照人员的生物吸收剂量。
综上所述, 本研究证实了CalyculinA诱导PCC技术可以作为一种方法来估算低剂量受照者的吸收剂量。但是用Giemsa染液染色法在阅片的过程中畸变的分析还较困难, 可以将CalyculinA法PCC与荧光标记的泛着丝粒探针结合以减低畸变的分析难度, 提高分析的准确性。
| [1] |
Gotoh E. Drug-induced premature chromosome condensation (PCC) Protocols:cytogenetic approaches in mitotic chromosome and interphase chromatin[J]. Methods Mol Biol, 2009, 523: 83-92. DOI:10.1007/978-1-59745-190-1 |
| [2] |
Wang ZZ, Li WJ, Zhi DJ, et al. Biodosimetry estimate for high-LET irradiation[J]. Radiat Environ Biophys, 2007, 46: 229-35. DOI:10.1007/s00411-007-0110-7 |
| [3] |
Gotoh E, Kawata T, Durante M. Chromatid break rejoining and exchange aberration formation following gamma-ray exposure:analysis in G2 human fibroblasts by chemically induced premature chromosome condensation[J]. Radiat Biol, 1999, 75(9): 1129-1135. DOI:10.1080/095530099139601 |
| [4] |
Kawata T, Durante M, Furusawa Y, et al. Dose-response of initial G2-chromatid breaks induced in normal human fibroblasts by heavy ions[J]. Int J Radiat Biol, 2001, 77(2): 165-174. DOI:10.1080/09553000010007686 |
| [5] |
Balakrishnan S, Shirsath K, Bhat N, et al. Biodosimetry for high dose accidental exposures by drug induced premature chromosome condensation (PCC) assay[J]. Mutat Res, 2010, 699: 11-16. DOI:10.1016/j.mrgentox.2010.03.008 |
| [6] |
Lamadrid AI, Garcia O, Delbos M, et al. PCC-ring Induction in Human Lymphocytes Exposed to Gamma and Neutron Irradiaton[J]. Radiat.Res, 2007, 48: 1-6. |
| [7] |
王春燕, 佟鹏, 苟巧, 等. 用早熟凝集染色体环法研究中子诱发染色体畸变的剂量效应关系[J]. 畸变、癌变、突变, 2011, 23: 449-451. |
| [8] |
George K, Durante M, Wu H, et al. In vivo and in vitro measurements of complex-type chromosomal exchanges induced by heavy ions[J]. Adv Space Res, 2003, 31: 1525-1535. DOI:10.1016/S0273-1177(03)00088-7 |
| [9] |
白玉书, 黄绮龙, 马剑锋, 等. 高剂量率射线照射离体血建立染色体畸变的剂量-效应曲线[J]. 中国预防医学杂志, 2003, 4(2): 100-103. DOI:10.3969/j.issn.1009-6639.2003.02.012 |