辐照后细胞增殖能力的强弱反映了辐射防护剂对细胞的保护作用。1967年, Soloway等合成了BSH。在欧洲和日本, BSH主要用于脑肿瘤硼中子俘获治疗, 近期也逐渐开始应用于头颈部肿瘤和肝癌的治疗[1-5]。研究表明BSH对低线性能量转换辐射具有保护作用[6], 且临床应用显示BSH对正常组织毒性极小[7, 8]。笔者采用MTT法和克隆形成法分别检测了BSH对照后细胞增殖能力的影响, 发现一定浓度的BSH对辐照后细胞的增殖具有显著促进作用。
1 材料与方法 1.1 细胞株人宫颈癌细胞株(Hela)购自中国科学研究院细胞库, 人小肠绒毛上皮细胞株(HIEC)由第二军医大学防原教研室惠赠。
1.2 照射条件Gamma cell 40, 137Cs γ射线(复旦大学放射医学研究所), 3Gy一次性照射, 剂量率为0.8Gy /min。
1.3 主要试剂与仪器硼卡钠(BSH)购自捷克斯洛伐克Katchem有限公司; RPMI1640培养基购自美国Invitrogen公司; 小牛血清购自杭州四季青生物工程材料有限公司; 四甲基偶氮噻唑蓝(MTT)购自上海博光生物科技有限公司; 二甲亚砜(DMSO)购自上海博光生物科技有限公司; 酶联仪(Thermo ELECTRON CORPORATION); 凝胶成像系统(BIO - RAD Laboratories); CO2孵箱(Thermo ELECTRON CORPORATION)。
1.4 方法 1.4.1 细胞培养使用含10%小牛血清的RPMI1640培养基(含100 U/ml青霉素、100 U/ml链霉素), 将两细胞株于37℃, 5% CO2孵箱中培养, 2 ~ 3d传代一次, 取对数增长期细胞进行实验。
1.4.2 BSH对细胞增殖能力影响的MTT法测定收集对数生长期细胞, 用含10%小牛血清的RPMI1640培养基配制成单细胞悬液(细胞浓度为1 × 104个/ml), 接种于96孔细胞培养板中, 每孔200μl。37℃, 5% CO2孵箱中培养18h。用无血清培养基配制不同浓度的BSH溶液, 0.22μm滤膜除菌后每孔加入20μl, 使终浓度分别为1. 15, 0.575, 0.288, 0.144, 0.072, 0.036和0.018, 对照组加入等体积无血清培养基, 每个浓度设3个平行样本。继续培养72h, 弃去培养基, 每孔加入MTT (0.4 mg/ml) 200μl, 孵育4 h后去上清, 加入DMSO 200μl, 室温振荡10min至结晶完全溶解, 于酶联仪上波长570nm处测定各孔光吸收值(OD值)。
1.4.3 BSH对3Gy γ射线照射细胞增殖能力影响的MTT法测定配制BSH溶液使终浓度分别为0.115mg/ml, 0.0575mg/ ml, 0.0288mg/ml, 0.0144mg/ml, 0.0072mg/ml, 0.0036mg/ml, 继续培养24h后137Cs γ射线一次性照射, 照射剂量为3Gy。其他条件同上。
1.4.4 0.060mg/ml BSH对不同剂量γ射线照射细胞增殖能力影响的细胞克隆形成法测定收集对数生长期细胞, 用含10%小牛血清的RPMI1640培养基配制单细胞悬液(细胞浓度为500个/ml), 接种于6孔板中, 每孔2ml。37℃, 5% CO2孵箱中培养18h, 无血清培养基配制BSH溶液后0.22μm滤膜过滤, 给药组加入100μl使BSH终浓度为0.060mg/ml, 对照组加入等体积无血清培养基。继续培养24h, 137Cs γ射线一次性照射, 照射剂量分别为1,2,4, 6和8Gy。继续培养5d, 弃去培养基, 1 × PBS清洗2遍, 甲醇固定20min, l0% Gimesa染液染色20min, 蒸馏水冲洗后晾干, 凝胶成像系统计数。
1.5 统计分析采用SPSS 14.0软件对结果进行t检验统计学处理。
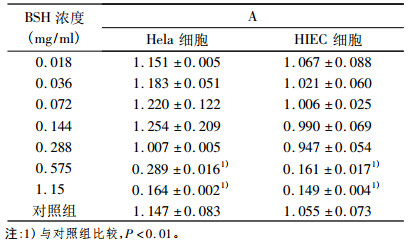
2 结果 2.1 BSH对细胞增殖能力的影响BSH对未照射细胞增殖能力的影响如表 1所示。BSH浓度在0.018mg/ml ~ 1.15mg/ml时, HIEC细胞增殖能力随浓度增加而下降, 呈一定的剂量依赖关系; BSH浓度在0.144mg/ml ~ 1.15mg/ml时, Hela细胞增殖能力随也与浓度呈剂量依赖关系; 在BSH浓度由0.288mg/ml到0.575mg/ml时, Hela、HIEC细胞增殖能力剧烈下降, 当浓度大于0.575mg/ml时, BSH对Hela、HIEC细胞的生长均有非常显著抑制作用(P < 0.01)。提示BSH在较高浓度时对Hela、HIEC细胞有毒性作用。
|
|
表 1 BSH对细胞增殖能力的影响 |
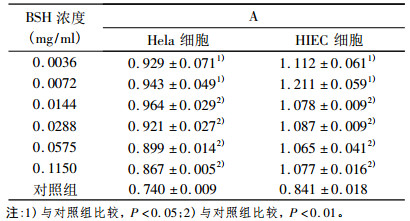
考察较低浓度BSH在3Gy γ射线照射Hela、HIEC细胞时对细胞增殖能力的影响, 结果如表 2所示。3Gy γ射线照射时, 0.0036mg/ml BSH对Hela、HIEC细胞均表现出显著的辐射保护效果(P < 0.05); 0.0072mg/ml BSH对Hela细胞有显著的辐射保护效果(与对照组比较, P < 0.05), 而对HIEC细胞则有非常显著的辐射保护效果(与对照组比较, P < 0.01);当BSH浓度为0.0144 mg/ml ~ 0.1150mg/ml时, BSH对Hela、HIEC细胞均表现出非常显著的辐射保护效果(P < 0.01)。提示较低浓度BSH对3Gy γ射线照射后细胞有显著的促进增殖作用。
|
|
表 2 BSH对3Gy γ射线照射细胞增殖能力的影响 |
结果如图 1所示, HIEC、Hela细胞克隆数均随着辐射剂量的增大而减少。对于Hela细胞, 与空白组比较, 当照射剂量为1 Gy、2 Gy时, BSH组细胞集落数非常显著增多(P < 0.01), 当照射剂量为4、6、8 Gy时, BSH组细胞集落数显著增多(P < 0.05);对于HIEC细胞, 与空白组比较, 当照射剂量为1、2、4 Gy时, BSH组细胞集落数非常显著增多(P < 0.01), 当照射剂量为6 Gy、8 Gy时, BSH组细胞集落数仅有上升趋势, 无统计学意义(P > 0.05)。提示一定浓度的BSH对不同照射剂量照射后HIEC、Hela细胞均有促进增殖作用, 照射剂量越低, 作用越显著。

|
图 1 0.060 mg/ml BSH对不同剂量γ射线照射细胞增殖能力的影响 A: Hela细胞, B: HIEC细胞; * :与对照组比较, P < 0.05; **:与对照组比较, ** P < 0.01。 |
笔者通过MTT实验检测了BSH对细胞增殖能力的影响。在未照射情况下, BSH浓度大于0.575mg/ml时, 对肿瘤细胞(Hela)和正常细胞(HIEC)的生长均具有显著的抑制作用。因此, 选择较低浓度BSH (0.0036mg/ml ~ 0.1150mg/ml)对辐照后细胞的增殖能力进行检测。
BSH浓度为0.0144mg/ml ~ 0.1150mg/ml时, 3Gy γ射线照射后HIEC、Hela细胞增殖能力均非常显著高于对照组。而浓度更低时, BSH对细胞增殖能力的保护作用逐渐减弱。说明仅一定浓度的BSH对照射后细胞增殖能力有非常好的保护作用, 提示BSH的浓度优化是发挥其辐射保护作用的关键。
利用克隆形成法检测60μg /ml BSH作用下1 ~ 8Gy γ射线照射后两细胞株的增殖能力。结果证明, BSH对Hela细胞受到不同剂量辐射损伤均具有显著保护作用, 对HIEC细胞仅在较低剂量辐射损伤时具有显著保护作用, 提示一定浓度的BSH对不同细胞株的辐射保护作用存在差异。文献报道BSH主要在肿瘤组织中聚集[9], 我们推测这可能是BSH对肿瘤细胞和正常细胞辐射保护作用存在差异的主要原因, 但本实验仅对2株细胞株进行了实验, 其结果是否具有普遍性还有待进一步研究证明。
| [1] |
Barth RF, Soloway AH, Goodman JH, et al. Boron neutron capture therapy of brain tumors:an emerging therapeutic modality[J]. Neurosurgery, 1999, 44(3): 433-450. DOI:10.1097/00006123-199903000-00001 |
| [2] |
Takagaki M, Oda Y, Miyatake S, et al. Boron neutron capture therapy:preliminary study of BNCT with sodium borocaptate (Na2 B12 H11 SH) on glioblastoma[J]. J Neurooncol, 1997, 35(2): 177-185. DOI:10.1023/A:1005766828165 |
| [3] |
Kageji T, Nagahiro S, Matsuzaki K, et al. Boron neutron capture therapy using mixed epithermal and thermal neutron beams in patients with malignant glioma-correlation between radiation dose and radiation injury and clinical outcome[J]. Int J Radiat Oncol Biol Phys, 2006, 65(5): 1446-1455. DOI:10.1016/j.ijrobp.2006.03.016 |
| [4] |
Wu G, Barth RF, Yang W, et al. Boron containing macromolecules and nanovehicles as delivery agents for neutron capture therapy[J]. Anticancer Agents Med Chem, 2006, 6(2): 167-184. DOI:10.2174/187152006776119153 |
| [5] |
Suzuki M, Masunaga S, Kinashi Y, et al. Intra-arterial administration of sodium borocaptate (BSH)/lipiodol emulsion delivers B-10 to liver tumors highly selectively for boron neutron capture therapy:experimental studies in the rat liver model[J]. Int J Radiat Oncol Biol Phys, 2004, 59(1): 260-266. DOI:10.1016/j.ijrobp.2003.12.018 |
| [6] |
Yoshida F, Matsumura A, Yamamoto T, et al. Enhancement of sodium borocaptate (BSH) uptake by tumor cells induced by glutathione depletion and its radiobiological effect[J]. Cancer Lett, 2004, 215(1): 61-67. DOI:10.1016/j.canlet.2004.06.023 |
| [7] |
Barth RF. A critical assessment of boron neutron capture therapy:an overview[J]. J Neurooncol, 2003, 62(1-2): 1-5. DOI:10.1007/BF02699929 |
| [8] |
Barth RF, Coderre JA, Vicente MG, et al. Boron neutron capture therapy of cancer:current status and future prospects[J]. Clin Cancer Res, 2005, 11(11): 3987-4002. DOI:10.1158/1078-0432.CCR-05-0035 |
| [9] |
Otersen B, Haritz D, Grochulla F. Binding and distribution of Na2B12H11SH on cellular and subcellular level in tumor tissue of glioma patients in boron neutron capture therapy[J]. J of Neurooncol, 1997, 33: 131-139. DOI:10.1023/A:1005789802603 |