研究表明,微波辐射对中枢神经系统的学习记忆功能具有明确的损伤效应[1]。中枢神经系统有多种学习记忆类型,除了海马脑区具有学习记忆功能外,小脑已被证实是运动性学习记忆的主要功能脑区[2]。蛋白激酶C(protein kinase C,PKC)能够调节多种细胞的代谢、生长、增殖和分化,在跨膜信号传递过程中起着重要作用。近年来,PKC活性在小脑运动性学习记忆中的作用机制成为国内外神经科学领域的研究热点之一[3]。本研究采用平均功率密度为90 mW/cm2的S波段微波持续辐射家兔30 min,检测微波辐射前后家兔小脑神经元PKC的活性水平,探讨微波辐射对小脑神经元PKC转位和激活的作用规律。
1 材料与方法 1.1 主要仪器和试剂低温超速离心机(Biofuge22R Heraeus,Germany); 电子天平(Sartorious,USA); 紫外分光光度计(Du - 640 Beckman,USA); 液闪测定仪(LS6500,USA); 热电偶点温计(深圳赛博); r-32P-ATP(北京亚辉); AC-MBP(Santa Crus,USA)。
1.2 实验动物及分组30只二级日本大耳白家兔,雌雄各半,体质量(2.14 ± 0.35) kg。实验分为对照组和微波辐射组,辐射组又设定辐射后0、3、24和72 h等四个时相组,每个时相组6只家兔。
1.3 微波辐射处理将辐射组家兔固定在专用丙烯酸甲酯有机玻璃辐射盒中,置于反射系数为零的辐射暗室内,在旋转平台上以平均功率密度为90 mW/cm2的S波段微波进行全身均匀辐射30 min。将对照组家兔置于相同环境中进行假辐射处理。暗室环境温度(20 ± 2) ℃,相对湿度(60 ± 10) %。
1.4 肛温测定辐射前和辐射后即刻用热电偶点温计测定家兔肛温,计算比吸收率(specific absorption rate,SAR)值。计算公式为: SAR = 4186C ΔT /t公式中: C为组织比热,取0.83 (kcal/kg.℃); ΔT为家兔在辐照前和辐射后即刻的肛温变化值(℃); t为辐射时间(s)。
1.5 小脑PKC的活性测定改良的TaKai法检测小脑PKC的活性。于相应时相点取家兔小脑组织,用蛋白裂解液(Tris.HCl 0.1 mol/L,EDTA 10 mmol/L,DTT 10 mmol/L,Aprotinin 500 μg/ ml,Leupeptin 500 μg/ml,Pepstatin A 500 μg/ml,PMSF 10 mmol/ L)分别提取胞浆和胞膜蛋白质,Lowry法进行蛋白质定量。分别取胞浆和胞膜蛋白质样品10 μg,加入激酶测定buffer 25 μl (含AC-MBP)和r-32P-ATP 5 μl,30 ℃水浴作用5 min。之后点样于Whatman滤膜上,用1%磷酸10 ml洗涤三次,80 ℃烘干,加入5 ml闪烁液,测定PKC的放射活性。结果用pmol. mg-1 ·min-1表示,每次实验重复3次。
1.6 统计学处理实验结果用均数±标准差表示,数据采用spss17.0软件进行统计分析,取P<0.05表示差异有统计学意义。
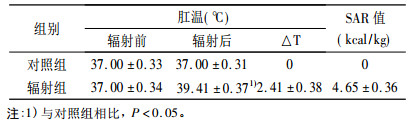
2 结果 2.1 微波辐射对家兔肛温和比吸收率的影响由表 1可知,给予90 mW/cm2微波辐射30 min后,家兔肛温平均升高2.41 ℃,SAR值为4.65kcal/kg。表明该剂量的微波辐射导致家兔机体产生了明显热效应。
|
|
表 1 微波辐射前后家兔肛温的变化和SAR值 |
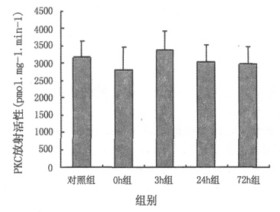
图 1的结果表明,给予90 mW /cm2微波辐射30 min后,家兔小脑神经元胞浆中PKC的活性在辐射结束后的各时相组结果与对照组相比,差异均没有统计学意义。
|
图 1 家兔小脑神经元胞浆中PKC的活性变化 |
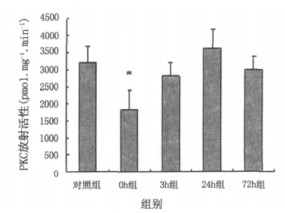
图 2的结果表明,给予90 mW /cm2微波辐射30 min后,家兔小脑神经元胞膜中PKC的活性在辐射结束后0 h显著降低(P<0.05),其余各时相组与对照组相比差异没有统计学意义。表明该剂量的微波辐射对家兔小脑神经元胞膜中PKC活性有显著影响。
|
图 2 家兔小脑神经元胞膜中PKC的活性变化 注:*与对照组相比P<0. 05。 |
神经科学研究表明,小脑不仅是维持机体平衡的重要器官,也是运动性学习记忆的主要功能脑区[4]。运动性学习记忆是对复杂的程序性活动进行学习并形成记忆的过程,它有别于海马脑区的学习记忆[5]。蒲肯野细胞是小脑皮质唯一的传出性神经元,在小脑学习记忆过程中起核心作用。突触长时程抑制(long term depression,LTD)是小脑运动性学习记忆功能的神经电生理学基础[6],小脑LTD的形成和保持受蒲肯野细胞上AMPA(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid)受体的调控。
AMPA受体在中枢神经系统内主要介导快速的兴奋性突触传递,在信号传导、神经发育以及突触的可塑性(包括学习和记忆)等方面都起着至关重要的作用。AMPA受体磷酸化改变是该受体发挥功能的主要形式。AMPA受体包括谷氨酸受体(glutamate receptor,GluR) 1、2、3和4等四种亚型,在小脑神经元中主要表达GluR2。因此,小脑的运动性学习记忆功能主要通过GluR2的磷酸化来实现。研究发现,GluR2的磷酸化主要由PKC来完成,其作用位点在GluR2的C末端的丝氨酸880位点处。
PKC是一类钙离子和磷脂依赖性的蛋白激酶,在中枢神经系统的细胞跨膜信号传递过程中起着十分重要的作用。PKC通过催化多种蛋白质上的丝氨酸或苏氨酸的磷酸化,调节多种细胞的代谢、生长、增殖和分化。PKC广泛分布于多种组织、器官和细胞中。在细胞处于静息状态时,PKC主要存在于胞浆中,当细胞受到内外因素的刺激后,PKC以钙离子依赖的形式从胞浆中移位到细胞膜上,此过程称之为转位。一般将PKC的转位作为PKC激活的标志[7]。PKC是小脑GluR2磷酸化的限速酶,在小脑LTD过程中起着重要作用。
中枢神经系统是微波辐射最为敏感的靶器官,其学习记忆功能障碍是最典型的损伤效应。大量研究发现,无论是急性大剂量还是慢性小剂量的微波辐射均可导致动物学习记忆能力明显下降[8]。因此,探讨微波辐射致学习记忆功能障碍的分子机理,具有十分重要的现实意义。本实验结果显示,家兔在微波辐射后肛温显著升高、PKC的转位和激活水平显著降低。PKC作为一种蛋白激酶,其功能活性受诸多因素的调控,而内环境温度的恒定是最基本的前提。因此,本实验中微波辐射所产生的热效应可能是PKC转位和激活能力降低的始动物理因素,由于微波辐射导致动物体温明显升高,使得PKC的转位和激活水平降低,最后将导致GluR2的磷酸化效率下降并影响小脑的LTD过程和运动性学习记忆功能。
| [1] |
John AD, Eleanor RA, John O. Behavioral and cognitive effects of microwave exposure[J]. Bioelectromagnetics, 2003, 24: 39-62. DOI:10.1002/(ISSN)1521-186X |
| [2] |
Jordan PS, Kogo T, Ying S, et al. Targeted in vivo mutations of the AMPA receptor subunit GluR2 and its interacting protein PICK1 eliminate cerebellar long-term depression[J]. Neuron, 2006, 49: 845-860. DOI:10.1016/j.neuron.2006.02.025 |
| [3] |
Mcdonald BJ, Chung HJ, Huganir RL. Identification of protein kinase C phosphorylation sites within the AMPA receptor GluR2 subunit[J]. Neurophamacology, 2001, 41: 672-679. DOI:10.1016/S0028-3908(01)00129-0 |
| [4] |
Welsh JP, Yamaguchi H, Zeng XH, et al. Normal motor learning during pharmacological prevention of Purkinje cell long-term depression[J]. Proc Natl Acad Sci USA, 2005, 102: 17166-17171. DOI:10.1073/pnas.0508191102 |
| [5] |
Koekkoek SKE, Hulscher HC, Dortland BR, et al. Cerebellar LTD and learning-dependent timing of conditioned eyelid responses[J]. Science, 2003, 301: 1736-1739. DOI:10.1126/science.1088383 |
| [6] |
Hee JC, Jordan PS, Richard LH, et al. Requirement of AMPA receptor GluR2 phosphorylation for cerebellar long-term depression[J]. Science, 2003, 300: 1751-1755. DOI:10.1126/science.1082915 |
| [7] |
Newton AC.Protein kinase C: structure, function, and regulation[R]. J Bio Chemis, 1995, 270(48): 28 495-28 498.
|
| [8] |
Zhavoronkov LP, Kolganova OI, Dubovik BV, et al. Effects of microwave radiation on conditioned behavior of rats[J]. Radiats Biol Radioecol, 2003, 43(1): 75-81. |