高能电子束是现代放射治疗中一种重要的治疗形式, 为浅表的和偏心的肿瘤提供了一个特殊的治疗选项。从20世纪50年代初期, 电子束就已经被用于放射治疗, 并在70年代随着医用电子直线加速器的推广和应用得到了很大的发展, 其疗效也得到了肯定。尤其在近几十年来, 随着放射物理学、放射生物学、临床肿瘤学和医学影像学的发展, 放射治疗技术领域发生了巨大的变革。
为此, 笔者就近十年来国内外许多学者对高能电子束的物理特性、临床治疗特点、吸收剂量测定及剂量学参数校正进行研究, 改进电子束治疗技术, 来提高高能电子束放射治疗的疗效。现对其主要进展予以讨论。
1 高能电子束的物理学特性及临床治疗特点 1.1 物理学特性电子是质量最小的带电粒子, 与X射线或γ射线不同, 它是在电子加速器中被加速到一定的高能时, 被直接引出用来治疗肿瘤。高能电子束可直接杀伤或电离细胞, 在生物学上的作用与γ射线或超硬光子无明显差异, 都属于低LET射线, 它们的相对生物效应(RBE)为1。但是, 电子束较之光子线有其特殊的几何学和物理学参数, 在治疗表浅肿瘤上具有独特的临床优势。
电子线在水或组织中吸收的剂量分布不同于X (γ)射线, 有其自身的优缺点, 表现为:
优点:①电子束能谱窄, 临床上被认为是单能射线, 在水或组织中具有一定射程。电子束的射程规定为入射电子沿其入射方向从入射物质表面到电子被物质吸收的最大直线距离, 而不是指电子在物质中所经过的全部路径。电子束能量越高, 其射程越大。而X (γ)射线强度随组织深度增加按指数和平方反比定律递减, 没有确定的射程。②在一定的深度之后, 剂量突然下降。这一"剂量跌落"是电子束最重要的剂量分布特性, 而X (γ)射线剂量跌落表现得很缓慢, 肿瘤组织后的正常组织剂量高。如果临床医生将病变选在80%区域内, 则病变后正常组织受量极小, 所以它能很好地保护肿瘤后面的正常组织器官。但是随着能量不断增加, 此特点逐渐消失, 因此临床应用的电子能量应在4~25MeV以内。
缺点:①从入射表面到一定的深度, 剂量高而且分布均匀; 随能量增加, 此深度也不断增加。剂量建成区很窄, 很快达到100%, 因此不能有效地保护皮肤。但是, X (γ)射线建成区变化显著, 肿瘤组织前正常组织受量少, 皮肤剂量也较电子线少。②韧致辐射污染, 电子束经过散射箔、监测电离室、X射线准直器和电子限光筒装置时, 并在射入水或组织中会因韧致辐射产生X射线。电子束能量越高, X射线污染越大, 对于双散射箔片的直线加速器, 4MeV时X射线污染小于1%, 20MeV时X射线污染小于4%。③电子束易被散射, 同时也易被阻挡。电子束能量越高, 小角度散射概率越大, 大角度散射概率减小; 电子束能量越低, 越易被散射, 大角度散射概率大。
1.2 电子线临床治疗的特点电子线治疗的特点取决于其百分深度剂量曲线的形态, 而电子线的能量、照射野以及源皮距都会影响其百分深度剂量曲线。AAPM TG25[1]推荐应当测量临床所用的所有能量、所有射野范围的百分深度剂量, 但是国内大多数单位由于设备等方面的原因, 难以全面测量中心轴剂量。
1.2.1 电子束能量对百分深度剂量的影响电子线百分深度剂量存在一个剂量变化相对平缓的高剂量坪区。随着电子能量提高, 包含最大剂量深度的区域会拓宽且移向深处。因此选择电子线能量时, 若靶区后无易损的正常组织, 可使95%、90%剂量深度包住靶区后缘, 以保证靶区收到充分的治疗, 同时靶区剂量也较均匀; 否则, 应将靶区后缘深度取在80%或85%剂量线, 以保护靶区后的正常组织。但应注意, 不能使靶区遗漏, 造成靶区剂量不足, 引起复发率上升。如乳腺癌的术后治疗, 往往以保证胸壁和肺的界面处百分深度剂量不超过80%(甚至70%左右)来选择射线能量, 以尽量减少肺组织的受量。
若将靶区后缘深度d后取在90%或95%剂量线, 电子线能量可近似选为:E0≈3(MwV/cm)× d后+2~3(MeV), 这种近似方法是考虑了各种预见因素(摆位误差、体位改变等)后的一种较为保险的方法, 但不适合于靶区后有易损正常组织的情况。
治疗的电子束最初接触到患者时, 具有一个平均入射能量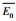
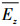
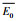
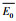
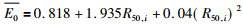
|
电子束的照射野通过加速器配置的限光筒和挡铅开孔共同影响着中心轴百分深度剂量曲线。有文献报道, 电子束照射野的剂量学特性和限光筒的设计密切相关[3-5]。
电子线的百分深度剂量与挡铅开孔有很大关系, 照射野较小、能量较高时, 随着照射野的减小, 最大剂量点深度移向表面, 治疗深度变浅, 剂量跌落变缓, 能量升高, 这种效应更明显; 当射野尺寸大于射程时, 这种效应不明显。AAPM TG25报告, 随着电子线能量的提高, 射程增大, 达到平衡所需的铅窗尺寸也增大。不过, Aird[6]认为射野半宽度小于电子射程时, 深度剂量有明显变化。而当射野半宽度大于电子半射程时, 深度剂量的变化难以观察到。
相同铅窗, 不同限光筒对于百分深度剂量曲线的影响不大, 只有在能量较高时, 限光筒的影响才变大。现今的医用直线加速器为电子线配备了射野跟随系统, 即限光筒与准直器铅门开合同步及对应, 从而以保证射野边缘的散射平衡, 减少对射野输出剂量率的影响, 满足临床所需要的射野平坦度要求。
因此, 在对患者治疗计划设计中, 包括电子束小射野, 射线束输出和全部的PDD分布必须明确。
1.2.3 空气间隙对百分深度剂量的影响空气间隙的改变表现为有效源皮距的不同, 当空气间隙增大时, 表面剂量降低, 最大剂量深度变深, 剂量梯度变陡, X射线污染略有增加, 高能时变化更为显著。这是由于受电子线有效源皮距的影响及它的散射特性, 和电子束在线束路径上与空气作用产生的X射线污染成分也略有增加; 基于同一原因, 剂量学中的距离平方反比定律对电子束输出剂量也产生些歧异。因此, 在临床应用中, 除非特殊需要, 我们应保持源皮距不变, 否则要根据临床使用条件实际测量它的百分深度剂量及其它相关物理剂量参数[7]。
2 电子线吸收剂量的测定剂量准确是放射治疗的基础。世界卫生组织(WHO)和国际原子能机构(IAEA)调查显示, 当前放射治疗中约有15%的患者接受的剂量不准确。加速器输出剂量的准确, 直接关系到靶区剂量的准确, 因此为保证输出剂量的准确度和治疗效果, 对电子线的常规剂量监测是十分必要的。
目前对于吸收剂量的测量有多种方法, 但在临床上大多用指型电离室在水模体中测量, 并使用IAEA277报告方法对高能X射线和电子束进行测量与计算, 使用此方法简便, 易行, 精度高, 对临床物理师有着积极的意义。IAEA 277号报告建议, 电子束在水模体表面的平均能量E0小于5MeV, 用平行板电离室; E0大于等于5MeV而小于10MeV, 用平行板电离室或指形电离室; E0大于等于10MeV, 用指形电离室。根据IAEA和美国医学物理师协会的放射治疗质量保证与质量控制要求, 输出剂量偏差达2%以上必须对加速器电离室剂量测量通道进行校准, 如果应用指形电离室来检测低能电子束, 会导致输出剂量校准存在较大的不确定性。
长期以来, 对高能光子束和高能电子束吸收剂量的测量推荐使用Cλ、CE方法。在标准水体模中, 束流中心轴上某特定深度处的吸收剂量如下:Dw=M·Nx·CE·KTP, Dw=Dm·PDD因此有:

|
而到80年代, 许多学术组织相继提出了新的测量规范, 其中最具代表性的是IAEA第277号技术报告。在标准水体模中, 束流中心轴上某特定深度处的吸收剂量如下:
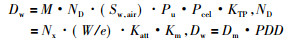
|
因此有: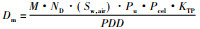
李军等[8]利用该IAEA新方法对电子束吸收剂量进行测量, 结果显示电子束的最大剂量校准误差为0.54%, 小于国家规定的2.0%要求。
Cλ、CE方法与IAEA方法的主要区别:①IAEA方法定义了电离室空气吸收剂量校准因子ND(ND与电离室的几何形状和收集极材料有关), 而不再使用空气照射量校准因子; ②体模中吸收剂量是由两部分组成:原射线和散射线, 所以Cλ、CE方法没有考虑散射线的影响; ③采用了电离室的有效测量点(Peff), 规定了新的输出剂量标定深度, 提高了测量精度, 减少了测量误差。这对临床放疗效果和减轻放疗副反应有较大意义。
3 电子束治疗计划设计时剂量学参数校正 3.1 电子束射野输出因子的修正射野输出因子也称射野输出转换系数, 是水模体中最大剂量深度处射野中心轴上该野的吸收剂量率与参考野10cm × 10cm吸收剂量率的比值。作为放射治疗剂量计算中的一个重要因子, 准确地测量和应用该因子在临床上具有重要意义。世界卫生组织(WHO)在放射治疗质量保证中规定该因子的精度必须> 2%[9]。
物理上通常只对方形野的输出因子进行测量, 因此对于电子线矩形野以及不规则射野的输出因子需要通过方形野的换算或实测得到。
电子束矩形照射野输出因子等效转换尚没有一个确定的方法。文献报道, 有三种计算方法可供临床参考使用, 即方根式、一维式和沿用X射线的面积周长比法。方根式和一维式是根据Ferm-Eyges多级散射理论而提出的, 由于这两种方法考虑了电子束在介质中线性角散射本领物理量, 其剂量计算精度较高; 而沿用X射线的面积周长法, 其精度不高, 不适用于电子束。张晶等[10]通过这三种方法计算和实测矩形野输出因子对比研究, 得出与上述相一致的结果。陈英海等[11]人研究表明:方根式法计算精度较高, 且它是利用2个方野输出因子乘积的方根计算的, 而方野的输出因子的测量方法、变化规律人们已有了较多的认识, 因此方根式法更适用于临床。但方根式法也有一定局限性, 计算电子束窄条野(短边≤3cm)输出因子有偏差, 临床应用建议实际测量。
对于高能电子束不规则射野的输出因子确定至今仍存在一些问题。有文献报道[12], 通过圆形野的输出因子, 得出电子束不规则射野输出因子的计算方法。具体方法实现:将一任意不规则电子束射野以射野的中心束轴为中心平均分割成n个扇形区域, 假定每个扇形域弧度半径分别为:R1, R2, …, Rn, 扇形域弧度α=360°/n, 对各扇形域半径求平均值, 则R=(R1+ R2+…+Rn)/n, 即将不规则射野等效转换为规则的圆形野, n取值越大, 两者间越等效。而电子束圆形野的输出因子用多项式拟合得到方程, 故电子束不规则射野的输出因子可以计算而近似得到, 计算值与实际测量值间差异无显著性。
3.2 电子束的斜入射校正电子束治疗中, 经常由于患者治疗部位的外轮廓呈弧形, 形成电子束的斜入射, 导致电子束输出剂量改变、等剂量分布曲线的畸变, 影响患者的疗效。电子束的斜入射增加了电子束限光筒断面与患者皮肤表面的空气间隙, 由于平方反比规律引起的射线束的扩散作用, 使所有深度的剂量都减小。研究表明斜入射不仅使最大电离深度值减小, 而且使电子线穿透能力减弱。因此斜入射对百分深度剂量的影响, 缘于电子束侧向散射效应和距离平方反比造成的线束扩散效应的双重作用的结果, 可用电子束斜入射校正因子(射线束垂直入射与斜入射的剂量比值)进行修正。
修正方法:D0(SSDeff, d)设为电子束垂直入射时有效源皮距SSD eff, 深度d处的剂量。斜入射时, 若空气间隙为g, 斜入射角为θ(入射点切线与射野中心轴的交角), 则深度d处的剂量为D(SSDeff+g, d)[13]:
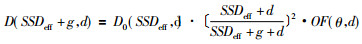
|
式中OF(θ, d)为斜入射校正因子, 表示射线束垂直入射与斜入射的剂量比值, 它可以通过测量或参考文献数据得到。
3.3 组织不均匀性校正目前临床放射治疗使用的标准数据一般是在均匀体模中测量得到的, 而真实人体各部位都是组织密度不均匀的, 如骨、肺和气腔不均匀组织, 它们的电子束剂量分布有显著变化, 必须对其校正。Engelsman M等[14]对真实人体各部位按组织均匀性和不均匀性分别剂量计算, 研究发现, 组织的不均匀性导致的剂量误差可达11%~32%。
通常采用的校正方法为等效厚度系数法(CET)。人体骨组织的CET值的范围为1.1(疏松骨)~1.65(致密骨); 对肺组织, 实验表明, 其CET值平均约为0.5, 并依赖于在肺组织中的深度。假设某种不均匀组织的厚度为Z, 它对电子束的吸收的等效水的厚度为ZXCET, 其中CET有不均匀性组织对水的相对电子密度求得。若计算位于厚度为Z的不均匀性组织后的某一点深度d处的剂量, 应先计算该点的等效深度deff, 然后经平方反比定律校正, 即可得该点剂量。等效深度为deff[13]:
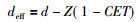
|
CET概念的有效性取决于非均质物的类型:对于像脑、肝、肾、脂肪等组织, Z和密度与水没多大差别; 对于肺, Z与水没多大差别, 但密度与水不同; 而对于骨, Z和密度都不同于水。
另一种方法是电子密度法。肺剂量校准中, 肺组织对水的相对电子密度, 也可认为近似等于其对水的相对密度, CT扫描显示, 肺相对于水的电子密度为0.2~0.25。若CET值等于其对水的相对电子密度, 则上式的CET值可用肺对水的相对密度代替来进行肺剂量校正。
4 电子束放疗技术的分类 4.1 电子束全身皮肤照射电子束全身皮肤照射(TSEI)主要用来治疗蕈样霉菌病, 皮下的T细胞淋巴瘤等全身范围的浅表病变。目前公认的全身皮肤恶性病变的标准治疗方法采用美国Stanford大学医学院建立的电子束双机架多方向照射, 这种照射技术能较好地满足全身皮肤浅表部位均匀受照的剂量学要求。陈立新[15]等人对全身皮肤电子束照射剂量学研究表明, 对于6、8MeV电子束双机架角6个野照射, 最大剂量深度都在0~3mm处, 6MeV的80%、50%剂量深度分别在7、14mm处, 8MeV的80%、50%剂量深度分别在7、17mm处。在机架旋转方向上模体2、11mm深度处野内各测量点的剂量均匀性在-10%~+3%内。同时, 电子线全身皮肤照射的急性毒副反应也得到了许多学者的关注。Parida DK[16]等研究了一种高剂量率的治疗模式能减轻电子线全身皮肤照射的毒副反应, 并可缩短治疗的疗程。4例蕈样霉菌病患者给予DT36Gy, 开始两周按5F/w照射, 余下的疗程按3F/w照射, 总疗程缩短为10w, 结果发现, 所有病例完全缓解, 而放疗产生的毒副作用如皮肤红斑、干性脱屑、湿性脱皮、皮肤溃疡、皮肤萎缩、色素沉着、毛细血管扩张、切口迟缓愈合较常规TSEI轻。
4.2 高能电子线术中照射高能电子线进行术中照射(IORT)已有30余年, 起先治疗胃肠部肿瘤, 现已广泛应用于头颈胸腹以致全身, 适应部位扩大, 病种增多。术中照射充分利用电子束的有限射程保护靶区后方组织的物理特点, 在直视下给予靶区大约15~50Gy的单次大剂量。电子线术中照射(EIORT)近年来逐步发展起来, 其优势在于:①准确确定手术瘤床位置, 直接照射有风险的组织; ②避免重要脏器受到照射, 减少放射损伤和第二原发肿瘤的发生; ③单次大剂量照射提高放射生物学效应, 术中单次照射剂量21Gy, 可相当于常规标准放疗58~60Gy的效应; ④减少治疗时间和手术-化疗间隔; ⑤有效解决难以往返放疗中心患者的难题。临床研究表明, 术中电子线放射治疗并发症少。M.Steiner[17]等研究了88例早期乳腺癌患者接受术中照射20Gy, 27例(32%)有局部并发症, 3例(3.6%)伤口感染, 20例(23%)血清肿, 3例(3.6%)有局部出血和血肿, 1例出现小部分皮肤坏死。
4.3 电子束旋转治疗技术电子束旋转治疗技术最早由Becker于1956年提出, 但直到80年代初因电子线剂量计算方法的突破才逐渐发展起来, 主要治疗面积较大、体表面弯曲的浅表病变, 如乳腺癌术后的胸壁及内乳淋巴引流区的照射。与电子束固定单野或多个切线野照射相比, 电子束旋转照射具有剂量均匀, 不会造成剂量冷热点, 及深部正常组织剂量低等优点。进入90年代以后, 随着CT诊断技术的普及, 电子线旋转治疗技术在乳腺癌术后胸壁照射和内乳区照射中表现出较大的优势, 表现为剂量分布更均匀、肺毒性和心脏毒性更低, 不仅提高了局部控制率, 而且远期生存率也有相应的提高[18]。Hehr T等[19]研究119例电子线旋转照射胸壁的乳腺癌术后患者, 2- 2.5 Gy/F, DT 50 Gy。5年局控率82%, 总生存率63%。Gaffney DK等[20]研究156例电子线旋转照射胸壁的乳腺癌术后患者, 全部患者都使用CT模拟定位, 作治疗计划。胸壁DT 50Gy, ≥ 2度的皮肤急、慢性反应分别为44%和10%。10年局控率为95%, 总生存率为52%。
4.4 电子束适形及调强放疗近年来随着影像诊断水平的提高和放疗技术的进步, 三维适形放射治疗及调强新技术推动着肿瘤放射治疗学的飞速发展, 并将成为21世纪放射治疗技术的主流模式。而电子束的精确放疗技术在国外有很多相关报道, Hogstrom[21]等人提出了电子线适形治疗技术(electron conformal therapy, ECT), 并使电子束照射射野满足三个要求:①给定剂量的90%必须包括计划靶区; ②获得尽可能均匀的剂量分布; ③降低皮下关键器官及正常组织的受照剂量。目前通过两种电子束适形治疗技术满足上述要求, 组织等效物补偿法和分割野适形技术, 主要治疗头颈部、乳腺癌术后胸壁及后壁肉瘤。组织等效物在电子线治疗中可以使不规则的体表变得平坦, 改进射野内部分区域的电子穿射效果, 增加表面剂量, 减少肺前缘受照剂量。另一种值得注意的治疗技术是电子线调强放射治疗(modulated electron radiotherapy, MERT), 通过电子线能量和强度的调节来实现表浅肿瘤的适形照射。有研究显示, MERT在乳腺两侧和深部方向的剂量适形程度优于光子切线照射和IMRT, 适于治疗乳腺癌等浅表病变[22]。Al-Yahya等[23]研究了运用电子多叶准直仪实现电子线能量调制放射治疗, 结果表明, 此法相对于3D-CRT和IMRT有更好的适形度, 靶区剂量的均匀性以及关键器官、正常组织的低受量。
5 展望电子线治疗有着类似于质子治疗的Bragg峰, 在高剂量峰后迅速锐减, 能很好得保护瘤后的正常组织, 这使得它在治疗浅表肿瘤方面仍具有很大的优越性。而且现代适形和调强等精确放疗技术的不断完善与, 也为高能电子束放疗向三维适形及调强放疗的发展成为未来趋势。同时, 电子束在剂量测定及相关剂量学参数校正仍需要研究改进。我们相信随着电子线治疗技术的广泛应用和经验积累, 以及剂量计算模型优化和三维计划系统的不断涌现, 将会使放疗精度不断提高, 使电子线放疗技术在肿瘤乃至其它功能性疾病的治疗上发挥更大的作用。
| [1] |
Khan FM, Doppke KP, Hogstrom KP, et al. Clinical electron beam dosimetry:report of AAPM radiation therapy committee task group No.25[J]. Med Phys, 1991, 18(1): 73-109. DOI:10.1118/1.596695 |
| [2] |
IAEA (International Atomic Energy Agency).The use of plant parallel ionization chambers in high energy electron and photon beams[P].An International Code of Practice Technical Report Series no 277(Vienna: IAEA), 1997.
|
| [3] |
Davies G, Bidmead M, Lamb C, et al. Electron dosimetry of angular fields[J]. Br J Radiol, 2007, 80(2): 202-208. |
| [4] |
Sharma SC, Hohnson MW, Gossman MS. Practical considerations for electron beam small field size dosimetry[J]. Med Dosim, 2005, 30(2): 104-106. DOI:10.1016/j.meddos.2005.02.001 |
| [5] |
Chow JC, Grigorov GN. Peripheral dose outside applicators in electron beams[J]. Phys Med Biol, 2006, 51(12): 231-240. DOI:10.1088/0031-9155/51/12/N01 |
| [6] |
Aird EG, Clincal electron therapy. Report on a meeting organized by the BIR Oncology Committee, held at the British Institute of Radiology, London, 7 November 1997[J]. Br J Radiol, 1998, 71: 1113-1115. DOI:10.1259/bjr.71.851.10434904 |
| [7] |
曾自力. 空气间隙对电子束吸收剂量的影响[J]. 中国辐射卫生, 2006, 15(4): 467. |
| [8] |
李军, 张西志, 谭飞. 高能X线和电子束吸收剂量的测量与计算[J]. 中国医学物理学杂志, 2008, 2: 564. |
| [9] |
WHO.Quality Assurance in radiotherapy[P].Geneva: WHO, 1988: 28-29.
|
| [10] |
张晶, 曲强. 电子束矩形照射野输出因子的探讨[J]. 医疗设备信息, 2005, 8: 66. |
| [11] |
陈英海. 电子束矩形野输出因子等效转换方法的对比实验研究[J]. 中华放射医学与防护杂志, 2002, 11(4): 237-239. |
| [12] |
单国平. 电子束不规则射野的输出因子研究[J]. 中华放射医学与防护杂志, 2004, 24(2): 163-165. DOI:10.3760/cma.j.issn.0254-5098.2004.02.029 |
| [13] |
胡逸民, 张红志, 戴建荣主编.肿瘤放射物理学[M].北京: 原子能出版社, 1999: 229-274.
|
| [14] |
Engelsman M, Damen EM, Koken PW, et al. Impact of simple tissue inhomogeneity correction algorithms on conformal radiotherapy of lung tumors[J]. Radiot Oncol, 2001, 60(3): 299-309. DOI:10.1016/S0167-8140(01)00387-5 |
| [15] |
陈立新, 卢杰, 梁健, 等. 全身皮肤电子束照射剂量学参数的测量和讨论[J]. 中华放射肿瘤学杂志, 2005, 14(4): 331-334. DOI:10.3760/j.issn:1004-4221.2005.04.022 |
| [16] |
Parida DK, Verma KK, Rath GK. Total skin electron irradiation treatment for mycosis fungoides with a new alternate daily treatment schedule to minimize radiation-associated toxicity:a preliminary experience[J]. Clin Exp Dermatol, 2009, 34(5): e37-e39. |
| [17] |
Steiner M, Rubinov R, Goldman J, et al. Intraoperative radiotherapy in early breast cancer?preliminary experience[J]. The Breast, 2009, 18: S48. |
| [18] |
王修身, 刘孟忠, 胡永红. 电子线旋转治疗技术在乳腺癌术后胸壁照射中的应用[J]. 癌症, 2004, 23(3): 358-360. |
| [19] |
Hehr T, Budach W, Durst I, et al. Postmastectomy electron- beam-rotation irradiation in locally.advanced breast cancer prognostic factors of locoregional tumor control[J]. Strahlenther Onko-l, 2002, 178(11): 624-632. DOI:10.1007/s00066-002-1012-x |
| [20] |
Gaffney DK, Leavitt DD, Tsodikov A, et al. Electron arc irradiation of the postmastectomy chest wall with CT treatment planning:20-year experience[J]. Int J Radiat Oncol Biol Phys, 2001, 51(4): 994-1001. DOI:10.1016/S0360-3016(01)01726-6 |
| [21] |
Hogstrom KR, Antolak JA, Kudchadker RJ, et al.2003 Modulated electron therapy Intensity Modulated Radiation Therapy, The State of the Art: Proc[A].2003 AAPM Summer School ed J Palta and R Mackie (Madison, WI: Medical Physics Publishing)[C].749-786.
|
| [22] |
Ma CM, Ding M, Li JS, et al. A comparative dosimetric study on tangential photon beams, intensity-modulated radiation (IMRT) and modulated electron radiotherapy (MERT) for breast cancer treatment[J]. Phys Med Biol, 2003, 48: 909-924. DOI:10.1088/0031-9155/48/7/308 |
| [23] |
Al-Yahya, Schwartz, Matthew, et al. Energy modulated electron therapy using a few leaf electron collimator in combination with IMRT and 3D-CRT:Monte Carlo-based planning and dosimetric evaluation[J]. Med Phys, 2005, 32(9): 2976-2986. DOI:10.1118/1.2011089 |



