电离辐射诱发的基因表达变化与被照射细胞及生物体的生物学反应密切相关。其中辐射诱发GADD45A基因的剂量效应尤为受关注。GADD45A基因为生长阻滞和DNA损伤基因,其编码一个约18kD大小的酸性蛋白[1]。该基因在人体细胞中广泛存在,可被多种电离辐射强烈诱导,可以p53依赖和非依赖的方式表达上调,参与了细胞的生长抑制和DNA的损伤诱导,在辐射诱导的细胞凋亡、细胞周期阻滞及DNA修复中起重要作用。众多研究表明,GADD45A基因由于其具有与DNA辐射损伤密切相关的生物学功能,且在一定剂量范围内存在剂量效应关系,故GADD45A基因表达的检测有望成为辐射生物剂量测定方法的可行指标,用于事故人员受照剂量的快速估算。
本研究利用实时荧光定量PCR方法,以β-actin作为内参基因,通过双标准曲线法研究电离辐射后正常人外周血GADD45A基因的表达变化,为辐射损伤标志物的研究及电离辐射生物剂量计的研究提供实验依据。
1 实验材料及方法 1.1 主要试剂及仪器RNAprep pure血液总RNA提取试剂盒(TIANGEN公司,北京); PrimeScriptTM RT reagent Kit(宝生物工程有限公司,大连); 实时荧光定量PCR试剂SYBR® Premix Ex TaqTM (Perfect Real Time) (宝生物工程有限公司,大连); Rotor-Gene 6000荧光定量PCR仪(Corbett Life Science公司,澳大利亚)。
1.2 血样标本的选取及照射 1.2.1 血样标本及分组选择无急慢性疾病、不抽烟、年龄在26 ~ 29周岁的3名男性非放射性工作者作为供血者,每人采集10 ml血液于EDTAK2抗凝管中,期间柔和摇动以防凝血。将每位供血者的血液分为10组,每组1ml,分为0.05、0.1、0.2、0.4、0.6、0.8、1、2和3 Gy 9个剂量组和1个对照组。
1.2.2 血样的照射及培养利用中国辐射防护研究院60Co照射装置对采集的血样分组照射,剂量率为0.313Gy /min。照射后的人外周血于37℃培养箱中静置2h后用于总RNA的提取。
1.3 人外周血淋巴细胞总RNA的提取及cDNA的合成 1.3.1 血液总RNA的提取血液总RNA的提取采用TIANGEN公司RNAprep pure血液总RNA提取试剂盒,获得的RNA直接用于cDNA的合成。
1.3.2 人外周血cDNA的合成cDNA的合成利用宝生物工程有限公司反转录试剂盒PrimeScriptTM RT reagent Kit完成,cDNA合成的反转录反应体系如表 1。
|
|
表 1 人外周血cDNA的合成 |
反转录反应条件: 37℃,15min(反转录反应),85℃,5sec (反转录酶的失活反应)。
1.4 实时荧光定量PCR引物的设计及合成本实验目的基因为人GADD45A基因,所选内参基因为人β-actin基因。GADD45A基因全序列来自GeneBank,基因登录号为NM_001924,实时荧光定量PCR的引物序列设计如表 2、3,序列合成委托宝生物工程有限公司合成。
|
|
表 2 GADD45A基因的实时荧光定量PCR引物设计 |
|
|
表 3 β-actin基因的实时荧光定量PCR引物设计 |
GADD45A基因的实时荧光定量PCR检测分析利用双标准曲线法,采用Rotor-Gene 6000荧光定量PCR仪完成,反应体系如表 4。
|
|
表 4 实时荧光定量PCR检测反应体系 |
实时荧光定量PCR反应条件: 95℃,10,95℃,5,60℃,20,共40个循环。
1.6 统计学处理实时荧光定量PCR采用双标准曲线法,以看家基因β-actin为内参,相对定量照射后样品靶基因的表达水平,即对照组(未照射组)标准样品的靶基因表达量为1,照射样品靶基因定量均为标准品的n倍。数据采用Origin 7.5软件进行数据统计分析与作图。
2 实验结果 2.1 RNA质量检测本实验提取的RNA样品经分光光度法检测,OD260/280比值大于1.8,表明RNA质量较高,可用于进一步实验。
2.2 SYBRGreen荧光定量PCR扩增特异性验证溶解曲线分析显示β-actin、GADD45A基因均为单峰(如图 1、2),表明荧光定量PCR扩增特异性较好。

|
图 1 GADD45A基因的溶解曲线 |
|
图 2 β-aetiri基因的溶解曲线 |
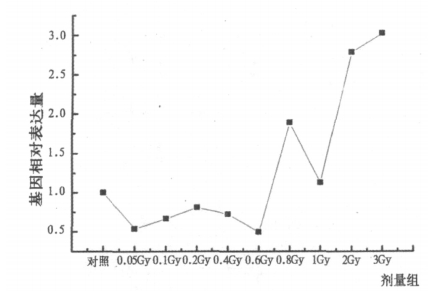
电离辐射后人外周血GADD45A基因及内参基因β-actin的扩增曲线如图 3、4。由荧光定量PCR扩增曲线可知,在第15个循环左右GADD45A基因进入指数扩增期,而内参基因β-actin在第10个循环后便进入了指数增长期。电离辐射对人外周血GADD45A基因表达的影响与照射剂量关系见图 5。如图,各剂量组与对照组相比,其基因表达均有显著变化。0.05 ~ 0. 6Gy剂量组与对照组相比基因表达下调,其中0.05 ~ 0.2Gy之间,随着照射剂量的增加,基因表达量逐渐升高; 0.2 ~ 0.6Gy之间,随着照射剂量的增加基因表达量又逐渐降低。0.8Gy时,基因表达量突然增加,高于对照组和1Gy剂量组。1 ~ 3Gy剂量组基因表达量均高于对照组,且随着剂量增大,表达量增加,具有明显剂量相关性。

|
图 3 β-actin基因的溶解曲线 |
|
图 4 β-actin基因扩增曲线 |
|
图 5 人外周血GADD45A基因表达与照射剂量的关系 |
电离辐射可导致DNA损伤,进而诱导细胞周期的G1期阻滞,使受损DNA得到修复的机会,从而进入下一个细胞周期,而未修复的细胞则失去活力被清除。以此机制维持细胞基因组的稳定性,减少肿瘤发生。目前研究认为野生型p53蛋白在G1-S期过渡中起关键作用。电离辐射可激活p53基因,其蛋白产物p53蛋白作为转录因子调控下游基因(GADD45,CIPUWAF2,Mdm2)的转录,并表达相应蛋白产物(GADD45,P21,Mdm2) [2]。因此,作为p53基因的下游基因GADD45A参与了细胞的生长抑制和DNA的损伤诱导。另外,GADD45A在辐射导致的细胞凋亡及DNA修复中发挥重要作用。
国内外研究表明,辐射可诱导GADD45A基因的表达变化。Grace等[3]运用实时定量PCR检测正常人外周全血细胞照射后GADD45基因的表达变化,发现其在1 ~ 3Gy剂量范围内表达与受照剂量呈线性关系。傅春玲等[4]应用RT-PCR定量分析不同剂量X射线体外照射对人外周血淋巴细胞GADD45基因表达的影响,结果表明,在1 ~ 5 Gy范围内,人体外周血淋巴细胞GADD45基因的表达与照射剂量呈指数相关。Gajdusek等[5]用RT-PCR技术研究发现,γ射线照射小鼠内皮细胞后,其GADD45A基因在5 ~ 15 Gy范围内呈剂量依赖性增加,在照射后8h内呈时间依赖性增加。徐丽昕等[6]研究X射线照射后GADD45基因的表达变化,结果表明人外周血经X射线照射后,GADD45基因在转录水平表达呈剂量性增强,照射后4h达峰值,以后开始下降,但在24h仍未恢复到初始水平。潘艳等[7]利用实时荧光定量PCR方法检测60Co γ射线照射后,正常人外周血永生化淋巴细胞系中GADD45基因mRNA表达水平的变化,结果显示GADD45基因mRNA表达水平随照射剂量的增高而增加。Fornace等[8]对人成髓细胞性白血病细胞系ML-1细胞的研究表明,人成髓细胞性白血病细胞系ML-1细胞中GADD45基因在2 ~ 50cGy剂量范围内有线性剂量-效应关系。
上述研究结果表明,辐射诱发的GADD45A基因表达呈剂量依赖性升高,本研究利用实时荧光定量PCR检测60Coγ射线诱发人外周血GADD45A基因的表达,结果显示1 ~ 3Gy剂量之间,GADD45A基因的表达与先前研究结果相一致,具有明显的剂量相关性。国内外有关辐射诱发GADD45A基因的研究的吸收剂量主要集中于1Gy以上,而关于小剂量诱发GADD45A基因表达变化的研究报道较少,本研究结果显示0.05 ~ 0.2Gy之间,GADD45A基因的相对表达量较对照组有所下调,究其原因,可能与辐射刺激效应有关。
辐射刺激效应是指低剂量照射可以刺激某些细胞功能,包括促进细胞增殖及修复,增强免疫能力,调节激素平衡,从而使机体自然防御功能得到提高的现象[9]。1986年UNSCEAR报告指出,就人体照射而言,低水平辐射指剂量在0.2Gy以内的低LET辐射或0.05Gy以内的高LET辐射。1994年UNSCEAR报告首次从官方角度提出,低剂量辐射可以产生辐射刺激效应。刘树铮等[10]对低剂量电离辐射诱导刺激效应机理的研究表明,与高剂量照射相反,低剂量照射后促细胞存活的蛋白分子表达上调,而促凋亡的蛋白分子表达下调。其中GADD45蛋白表达在低剂量照射时下调。本研究结果显示0.05 ~ 0.2Gy之间,GADD45A基因的相对表达量较对照组有所下调,该现象是否是人外周血淋巴细胞一种辐射刺激效应,还有待进一步研究。
实时荧光定量PCR技术是一种新的PCR方法,与传统的PCR法相比,具有无需进行PCR后处理,可对DNA扩增进行实时监测。由于其快速、灵敏等特点,目前已广泛应用于医学及生物学的各个领域。利用实时荧光定量PCR技术可以实现目的基因相对定量。对于相对定量一般有△△Ct法和双标准曲线法。这两种方法是基因表达调控研究中最常用与公认的两种相对定量分析方法。△△Ct法要求目的基因与看家基因的扩增效率一致且假定扩增效率为100 %,实验条件优化较为复杂。而双标准曲线消除了目的基因和看家基因扩增效率差别而造成的误差,结果更为准确,分析简单且实验优化简单。本研究在比较两种方法后采用双标准曲线法,使本研究结果更加准确可靠。
| [1] |
Hoffman B, Liebermann DA. Role of gadd45 in myeloid cells in response to hematopoietic stress[J]. Blood Cells Mol Dis, 2007, 39(3): 344-347. DOI:10.1016/j.bcmd.2007.06.011 |
| [2] |
Hollander MC, Alamo F, Jackman J, et al. Sequence conservation and DNA damage-responsiveness of mammalian gadd45 gene[J]. J Biol Chem, 1993, 268: 24385-24393. |
| [3] |
Grace MB, McLeland CB, Blakely WF. Real-time quantitative RT-PCR assay of GADD45 gene expression changes as a biomarker for radiation biodosimetry[J]. Int J Radiat Biol, 2002, 78(11): 1011-1021. DOI:10.1080/09553000210158056 |
| [4] |
傅春玲, 童建, 江伟威, 等. X射线诱导人外周血淋巴细胞GADD45和p21基因表达上调[J]. 辐射研究与辐射工艺学报, 2004, 22(4): 229-233. DOI:10.3969/j.issn.1000-3436.2004.04.009 |
| [5] |
Gajdusek C, Onoda K, London S, et al. Early molecular changes in irradiated aortic endothelium[J]. J Cell Physiol, 2001, 188(1): 8-23. DOI:10.1002/(ISSN)1097-4652 |
| [6] |
徐丽昕, 艾辉胜, 蒋本荣, 等. 电离辐射对人外周血淋巴细胞GADD45基因表达的影响[J]. 辐射研究与辐射工艺学报, 2006, 24(2): 111-114. DOI:10.3969/j.issn.1000-3436.2006.02.010 |
| [7] |
潘艳, 李玉文, 封江彬, 等. 60Coγ射线照射淋巴细胞诱导PIG3和GADD45基因mRNA变化[J]. 辐射研究与辐射工艺学报, 2008, 26(5): 309-313. DOI:10.3969/j.issn.1000-3436.2008.05.012 |
| [8] |
Fornace AJ Jr, Amundson SA, Do KT, et al. Stress-gene induction by low-dose gamma irradiation[J]. Mil Med, 2002, 167(2 Suppl): 13-15. |
| [9] |
从慧玲. 实用辐射安全手册[M]. 2版. 北京: 原子能出版社, 2007: 124.
|
| [10] |
刘树铮. 低剂量辐射兴奋效应发生机理若干问题的讨论[J]. 中华放射医学与防护杂志, 2003, 23(6): 393-398. DOI:10.3760/cma.j.issn.0254-5098.2003.06.001 |



 ,
, 


