基因芯片技术是伴随着人类基因组计划的实施而发展起来的新兴生物学技术, 它具有高通量、高集成、微型化和自动化的特点[1, 2]。目前已被应用于生物学研究的各个领域, 辐射生物学领域的研究也不例外。而高密度的基因芯片不仅针对性不强, 产生繁琐的实验数据, 而且耗费大量资金, 为此已有人针对肿瘤研制出了不同的诊断芯片[3-5]。本研究主要是在0.1Gy、0.2Gy、0.5Gy、1.0Gy四个剂量水平照后6h进行了离体人外周血淋巴细胞辐射差异基因的筛选, 为进一步辐射差异基因的筛选和辐射损伤机制的研究提供依据。
1 材料与方法 1.1 血样采集选择4名无放射性接触史、无急慢性疾病、不吸烟、年龄在25~35岁之间的健康男性作为供血者, 每人静脉取血100ml, 肝素抗凝。
1.2 外周血淋巴细胞的分离用等体积的D-hanks液在无菌条件下稀释混匀新鲜采取的肝素抗凝血, 沿离心管壁加到等体积淋巴细胞分离液的液面上, 以2 000转/min离心20min。离心结束后, 离心管液面分为四层, 从上到下依次为血浆层、环状乳白色淋巴细胞层、透明分离液层及红细胞层, 小心吸取第二层淋巴细胞至离心管中, 并加等体积D-hanks液, 以2 000转/min离心10min, 倒掉上清液, 同样方法再重复洗涤一次, 然后用计数板在显微镜下计数。
1.3 细胞培养将提取出来的淋巴细胞用含13%的灭活小牛血清、200U/ml青霉素、200ug/mg链霉素的RPMI-1640培养液分别装于25mL的培养瓶中, 并置于37℃、5% CO2培养箱培养。
1.4 细胞照射将培养过夜的淋巴细胞用中国辐射防护研究院实验用钴-60辐照装置照射, 一次性照射剂量分别为0.1Gy、0.2Gy、0.5Gy、1.0Gy四个剂量, 照射剂量率为31.93cGy/min, 源皮距80.5cm, 误差范围在0.3%。
1.5 总RNA提取经过照射的淋巴细胞迅速放回37℃、5% CO2培养箱继续培养, 并分别于照后6 h用Trizol提取照射组及未照射组淋巴细胞总RNA, 并经琼脂凝胶电泳检测和紫外分光光度计定量合格后, -80℃保存备用。
1.6 探针标记与杂交参照Illumina TotalPrepRNA扩增试剂盒进行RNA的扩增和纯化; 杂交试剂配制及芯片杂交; 室温孵育; E1BC洗液、乙醇的室温洗涤及染色; 干燥。
1.7 差异表达基因的荧光扫描和分析通过BeadScan扫描和数据获取软件对芯片灰度扫描图进行分析, 得到芯片上每个基因点的原始信号值, 即所有有效重复点的前景信号值减去背景信号值的平均值, 然后利用BeadStudio数据分析软件进行分析处理。判定基因差异表达的标准是通过DiffScore值来体现的, DiffScore是一种差异分值, 它体现一个探针在两种组织中的差异表达程度, 当DiffScore值大于20或小于-20时才认为有差异表达, DiffScore值大于20认为是高表达, 小于-20认为是低表达。
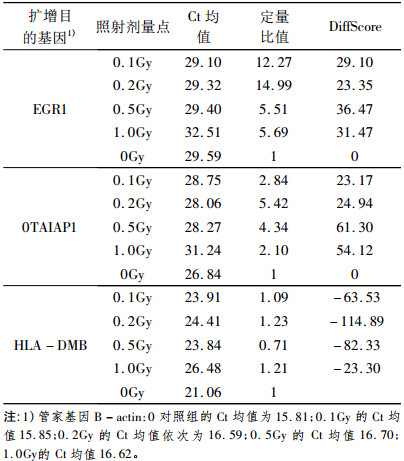
1.8 RT-PCR对基因芯片结果的验证采用SYBR Green实时荧光定量PCR技术对所筛选的3个有差异表达且有意义的基因进行验证, 分别是EGR1、TAIAP1、HLA-DMB, 并以B-actin为内参控制基因。用ABI Prism 7 900进行实时PCR扩增, 每样品做3个平行样, 并用ABI Prism 7 900 Sequence Detection System软件进行分析。
2 结果本研究采用的是美国Illumina公司Human-6全基因组表达谱微珠芯片, 它可以同时获得37 000个转录子的表达情况, 并且具有样本需求量少(每张芯片仅需50~100ng总RNA样本)、50碱基的全长探针设计提供更可靠的特异性和敏感度、冗余度设计(每个点重复30倍)提供更准确地数据等特点, 非常适合高通量水平上的生物学领域研究。本研究通过对0.1Gy、0.2Gy、0.5Gy、1.0Gy四个剂量水平照后6h点离体人外周血淋巴细胞基因芯片结果与未照射组的结果进行分析比较, 有如下实验结果:
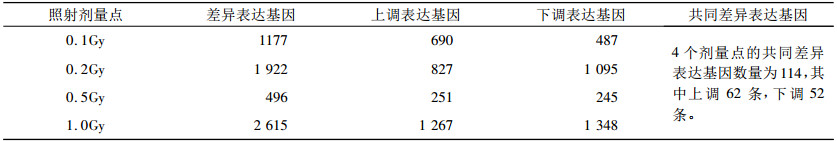
2.1 0.1Gy照后6h的差异基因结果离体人外周血淋巴细胞在0.1Gy剂量水平上照后6h点与未照射组进行比较, 所筛选出的差异基因有1177条, 其中上调表达有690条, 下调表达有487条。(具体的差异基因数量详见表 1)。
|
|
表 1 外周血淋巴细胞不同剂量在照后6h的差异基因结果 |
离体人外周血淋巴细胞在0.2Gy剂量水平上照后6h点与未照射组进行比较, 所筛选出的差异基因有1 922条, 其中上调表达有827条, 下调表达有1 095条。(具体的差异基因数量详见表 1)。
2.3 0.5Gy照后6 h的差异基因结果离体人外周血淋巴细胞在0.5Gy剂量水平上照后6h点与未照射组进行比较, 所筛选出的差异基因有492条, 其中上调表达有251条, 下调表达有245条(具体的差异基因数量详见表 1)。
2.4 1.0Gy照后6 h的差异基因结果离体人外周血淋巴细胞在1.0Gy剂量水平上照后6h点与未照射组进行比较, 所筛选出的差异基因有2 615条, 其中上调表达有1 267条, 下调表达有1 348条。(具体的差异基因数量详见表 1)。
2.5 4个剂量水平上照后6 h的共同差异基因结果离体人外周血淋巴细胞在0.1Gy、0.2Gy、0.5Gy、1.0Gy四个剂量水平上照后6h与未照射组相比较, 所筛选出的共同差异基因有114条, 其中上调表达有条, 下调表达有条, 并且GADD45A (Homo sapiens growth arrest and DNA-damage-inducible)、ZNF154基因(Homo sapiens zinc finger protein 154)等基因体现出了一定的剂量效应关系(具体的差异基因数量详见表 1)。
2.6 实时荧光定量RT-PCR对差异表达基因的验证结果结果显示, EGR1(早期响应因子1)、HLA-DMB (主要组织相容复合体)及TAIAP1(细胞凋亡调节抑制基因)三个基因的溶解曲线在不同剂量点及不同时间点均为单峰, 表明上述基因均为特异性产物; 通过对EGR1(早期响应因子1)、HLA-DMB (主要组织相容复合体)及TAIAP1(细胞凋亡调节抑制基因)基因的扩增曲线进行相对定量结果分析。相对定量比值的计算公式:Fold=2-△△Ct=2-(△Ct1-△Ct2)式中△Ct1-△Ct2=(Ct待测基因, 样本1-△Ct管家基因, 样本1)-(Ct待测基因, 样本2- △Ct管家基因, 样本2)并将各剂量及照后不同时间点与基因芯片检测的Diffscore值进行比较, 发现这三个基因的RT-PCR结果与基因芯片检测结果的差异表达趋势是一致的, 扩增引物、扩增条件及扩增的相对定量结果分别见表 2、表 3。
|
|
表 2 RT—PCR扩增基因的引物序列及扩增条件 |
|
|
表 3 RT——PCR扩增的相对定量结果 |
在本研究过程中发现早期生长应答因子-1(EGR1)在0.1Gy、0.2Gy、0.5Gy、1.0Gy四个照射剂量照后6h均出现了差异表达; 早期生长响应基因2(EGR2)在0.1Gy、0.2Gy、0.5Gy、1.0Gy四个照射剂量照后6h点均出现了差异表达。已有研究表明[6], 在EGR1基因的调控序列中含有6个保守的CC (A/T)6GG结构域, 而这些结构域可感受细胞内外的理化刺激诸如自由基、电离辐射等, 继而诱导基因的高表达; 还有研究[7]利用EGR1基因的辐射诱导性, 将EGR1基因启动子与肿瘤杀伤基因进行耦联, 构建了辐射诱导性基因表达调控系统。在GeneBank数据库功能研究中认为EGR是与细胞间信号转录有关的基因。
3.2 电离辐射对生长抑制、DNA损伤基因(GADD45)的影响Grace等[8]研究后认为, 生长抑制、DNA损伤基因(Growth arrest and DNA damage gene 45, GADD45)位于p53基因的下游, 与辐射诱导细胞周期阻滞关系密切。徐丽矽等[9]研究了照射剂量与GADD45基因表达的关系, 对其作为辐射生物剂量计的可行性进行了探讨。本研究过程中发现GADD45A在0.2Gy、0.5Gy、1.0Gy照后6h点均出现了差异表达, 同时在0.1Gy照后6h点还发现了GADD45G也出现了差异表达, 而在GeneBank数据库功能研究中认为GADD45是与DNA修复、细胞凋亡及细胞周期调控等功能有关的基因。
3.3 电离辐射对丝/苏氨酸激酶(BRSK1)的影响本研究过程中发现0.2Gy照后6hBRSK1均出现了差异表达, 并且本研究室在离体外周血淋巴细胞0.2Gy剂量水平上前期筛选过程中也发现了BRSK1在12h、24h点的差异表达[10], 而在GeneBank数据库功能研究中认为BRSK1是与电离辐射响应有关的基因。
3.4 电离辐射对肿瘤坏死因子(TNF)的影响在本研究过程中发现肿瘤坏死因子受体10B (TNFRSF10B)、肿瘤坏死因子相互作用蛋白1(TNIP1)及肿瘤坏死因子α诱导蛋白8(TNFAI8L2)在0.1Gy、0.2Gy、0.5Gy、1.0Gy四个剂量照后6h均出现了差异表达。而在GeneBank数据库功能研究中认为TNF是与免疫响应、细胞凋亡、细胞分化及信号转导等有关的基因。曹明富等[11]经研究后认为肿瘤坏死因子可调节细胞对电离辐射的敏感性, 而在肿瘤病人放疗时使用时, 则能提高病人正常组织对电离辐射的抗性, 增加肿瘤对放疗的敏感性。
3.5 电离辐射对TP53细胞凋亡调节抑制基因(TRIAP1)的影响在本研究过程中发现及0.1Gy、0.2Gy、0.5Gy、1.0Gy照后6h均发现了TP53细胞凋亡调节抑制基因(TRIAP1)有差异表达, 而在GeneBank数据库功能研究中认为TRIAP1是与DNA损伤、细胞凋亡及细胞周期抑制中由P53族基因引起的信号转导。
4 结论总之, 本研究在0.1Gy、0.2Gy、0.5Gy、1.0Gy四个剂量水平上照后6h的研究过程中发现了许多有意义的差异基因, 这将为进一步辐射差异基因的筛选和辐射损伤机制的研究提供依据。
| [1] |
Schena M, Shalon D, Davis RW, et al. Quantitative monitoring of gene expression patterns with a complementary DNA microarray[J]. Science, 1995, 270(5235): 467-470. DOI:10.1126/science.270.5235.467 |
| [2] |
Schena M, Shalon D, Heller R, et al. Parallel human genome analysis:Microarray based expression monitoring of 1000 genes[J]. Proc Natl Acad Sci USA, 1996, 93(20): 10614-10. DOI:10.1073/pnas.93.20.10614 |
| [3] |
郭万峰, 王升启, 黄坚, 等. 电离辐射相关低密度寡核苷酸基因芯片的制备[J]. 第四军医大学学报, 2006, 27(1): 66-69. DOI:10.3321/j.issn:1000-2790.2006.01.020 |
| [4] |
Yao J, Feng B. Combined cDNA array comparative genomic hybridization and serial analysis of gene expression analysis of breast tumor progression[J]. Cancer Res, 2006, 4065. |
| [5] |
Sanch EZ-Carbayo M, Soccin ND, Lozano J, et al. Defining molecular profiles of poor outcome in patients with Invassive bladder caner using oligonucleotide microarrays[J]. Clinical Oncology, 2006, 24(5): 778-789. DOI:10.1200/JCO.2005.03.2375 |
| [6] |
蒋鸣, 许建华, 陈森清. Egr-1基因辐射诱导表达的研究[J]. 江苏预防医学, 2008, 19(4): 64-66. DOI:10.3969/j.issn.1006-9070.2008.04.036 |
| [7] |
王富友. Egr-1基因启动子介导肿瘤基因放疗的研究进展[J]. 疾病控制杂志, 2004, 8(5): 456-459. DOI:10.3969/j.issn.1674-3679.2004.05.023 |
| [8] |
Grace MB, Mcleland CB, Blakely WF. Real-time quantiat tive RT-PCR assay of GADD45 gene expression changes as a biomaker for radiation biodosimertry[J]. INT J Radiat Biol, 2002, 78(11): 1101-1121. |
| [9] |
徐丽矽, 艾文胜, 蒋本荣, 等. 电离辐射对人外周血淋巴细胞GADD45基因表达的影响[J]. 辐射研究与辐射工艺学报, 2006, 24(2): 111-114. DOI:10.3969/j.issn.1000-3436.2006.02.010 |
| [10] |
李建国, 闻建华, 左雅慧, 等. 0.2Gyγ射线照射人外周血淋巴细胞不同时间点差异基因表达谱研究[J]. 辐射防护, 2010, 30(4): 220-225. |
| [11] |
曹明富, 应蓓蓓, 徐人尔. 7-5TNFα和β对电离辐射诱导细胞凋亡效应的研究[J]. 癌变·畸变·突变, 1999, 11(6): 320. |