2. 中国医学科学院放射医学研究所天津市分子核医学重点实验室, 天津 300192
2. Key Laboratory of Molecular Nuclear Medicine, Institute of Radiation Medicine, Chinese Academy of Medical Sciences and Peking Union Medical College, Tianjin 300192 China
放射治疗是目前临床上肿瘤治疗的经典手段之一, 约70%~80%的肿瘤病人在治疗过程中需要接受放射治疗, 基因治疗技术也正日益渗入肿瘤的治疗中。根据放疗和基因治疗各自的特点, 美国肿瘤放射治疗学家Weichselbaum[1]于1992年提出将两者联合应用, 即肿瘤的基因-放射治疗的设想。人白细胞介素21(interleukin-21, IL-21)是最近命名的Ⅰ型细胞因子, 由活化的CD4+ T细胞合成, 与IL-2、IL-4和IL-15高度同源。Parrish-Novak等研究证实[2], IL-21的基因定位于4q26-q27。现已证实IL-21与移植排斥反应[3]及自身免疫病[4]密切相关, 并具有抗肿瘤作用[5, 6]。本研究用我们构建好的含人IL-21基因的重组腺病毒表达载体(Ad-IL-21)感染食管癌细胞EC109, 并进行γ射线照射, 观察IL-21基因联合放疗对肿瘤细胞生长和细胞周期的影响, 探讨其联合抑瘤作用, 为临床上进行IL-21基因-放射治疗肿瘤提供实验依据。
1 材料与方法 1.1 人食管癌细胞株EC109由天津医科大学免疫教研室惠赠。
1.2 主要试剂和仪器RPMI1640培养基(北京赛默飞世尔), MTT(天津华大欣源), 分析纯二甲基亚砜(天津市江天化工科技), 小牛血清(杭州四季青生物工程材料公司), Ad-IL-21及对照腺病毒Ad-lacZ由中国医学科学院放射医学研究所构建保存[7]。137Cs γ射线照射源(USD, 加拿大), 酶标仪(美国Thermo公司), 流式细胞仪(美国Beckman公司, AltraⅡ)。
1.3 EC109细胞培养及实验分组EC109细胞用含10%小牛血清的RPMI1640培养基, 在37℃、5% CO2饱和湿度条件下培养。按以下方法分组:①空白对照组:不做任何处理; ②Ad - lacZ组:每孔加入含lacZ基因但不含IL-21基因的对照腺病毒; ③Ad-IL-21基因组:每孔加入含IL-21基因的重组腺病毒; ④单独照射组:采用137Cs γ射线照射源6Gy进行照射, 剂量率为0.75Gy/min; ⑤联合治疗组:加入IL-21后6h进行6Gy γ射线照射。
1.4 IL-21基因对EC109肿瘤细胞生长的影响转染前1天取对数生长期的EC109细胞并计数, 按每孔3 × 103个细胞接种于96孔板, 转染当天按上述分组处理, 每组做6个复孔, 每孔加100μl Ad-IL-21(病毒滴度为9 × 1011 pfu/ml)。每组分别于处理后培养0、1、2、3和4d后加入0.5% MTT液20μl, 孵育4h后酶标仪测定492nm吸光度(A)值。绘制细胞生长曲线图, 并计算细胞生长的抑制率:抑制率(%)=(1-实验组A值/对照组A值) × 100%。
1.5 IL-21基因对EC109肿瘤细胞的细胞周期影响于转染前1天取对数生长期EC109细胞, 按每孔3 × 105个细胞接种于6孔板, 转染当天按上述分组处理, 每组做2个复孔, 每孔加200μl Ad-IL-21 (病毒滴度为9 × 1011 pfu/ml)。转染后48h收集所有悬浮及贴壁细胞, 每组各2孔用冷PBS液洗涤2次, 70%冰乙醇4℃固定1h, -20℃保存。检测前用冷PBS液洗涤2次, 加入800μl碘化丙啶(PI), 混匀, 暗处避光反应30min, 上流式细胞仪488nm波长检测细胞周期。
1.6 统计方法采用SPSS13.0软件包进行单因素方差分析比较存活细胞数量, 以P<0.05为有统计学意义。
2 结果 2.1 Ad-IL-21转染后食管癌EC109细胞生长的抑制曲线从生长曲线看出, 空白对照组、Ad-lacZ组和Ad-IL-21基因组EC109细胞数量随培养时间延长呈增加趋势。转染后第2天开始, 单独照射组和联合治疗组细胞生长明显缓慢, 与Ad-IL-21基因组和Ad-lacZ组比较差异有统计学意义(F= 145.269, P<0.05);联合治疗组与单独照射组和Ad-lacZ组比较差异有统计学意义(F=98.907, P<0.05)。在转染后第3天, Ad-IL-21基因组的细胞生长开始明显比空白对照组和Ad-lacZ组慢(F=7.181, P<0.05), 空白对照组与Ad-lacZ组相比差异无统计学意义(P > 0.05), 其中联合治疗组细胞生长最为缓慢, 见图 1。

|
图 1 Ad-IL-21作用于EC109细胞的生长抑制曲线 |
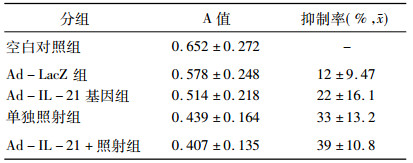
Ad-IL-21基因组、单独照射组和联合治疗组对EC109细胞生长均有抑制作用, 单独照射组的抑制率显著高于Ad-IL-21基因组, 联合治疗组的抑制效应最强, 达到39%。联合治疗组与Ad-IL-21基因组比较差异有统计学意义(P<0.05), 见表 1。结果提示, Ad-IL-21基因对EC109细胞的生长具有抑制作用, 而Ad-IL-21基因与放射治疗联合应用能更有效地抑制肿瘤细胞的生长。
|
|
表 1 Ad-IL-21转染后EC109细胞生长的抑制率 |
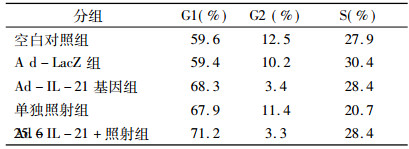
从流式细胞仪分析结果可见, 与空白对照组和Ad-lacZ组相比, Ad-IL -21基因组、单独照射组和联合治疗组EC109细胞停留在G1期的细胞增加, 联合治疗组G1期细胞所占比例最高, 达到71.2%, 且G2期细胞最少为3.3%, 见表 2。结果表明, Ad-IL-21联合照射使EC109细胞主要阻滞在G1期。
|
|
表 2 Ad-IL-21转染后EC109细胞的细胞周期 |
放疗是当前治疗恶性肿瘤的主要方法之一, 而基因治疗是近来兴起的一种肿瘤生物治疗方法。目前, 肿瘤的基因联合放射治疗已经成为放疗和基因治疗新的研究方向之一, 两者之间存在着相互增强的作用。其机制可能是由于射线照射后增加基因转染的效率和(或)促进基因的表达, 另外基因转染后可增加肿瘤细胞对射线的敏感性, 两者联合应用具有协同作用。有研究报道[8], 将IL-21基因导入肿瘤细胞内, 可以促使肿瘤局部T细胞的增殖、活化、增加IFN-r的分泌, 促进NK细胞的分化成熟, 从而加强NK、CTL细胞的细胞毒活性, 发挥强大的抗肿瘤免疫作用。IL-21基因治疗有望在将来的肿瘤生物治疗中发挥重要作用。目前, IL-21在体内抗肿瘤的研究已有报道[9, 10], 但其对食管癌作用的报道却很少。
本研究以重组腺病毒Ad-lacZ作为对照, 目的是为了确定腺病毒中IL-21基因的作用, 发现Ad-lacZ本身对食管癌细胞的生长没有影响, 表明对肿瘤细胞的抑制作用来自转导的IL-21基因的表达, 而不是腺病毒载体本身。
本实验采用我们已构建好的Ad-IL-21重组腺病毒载体转染EC109细胞, Ad-IL-21基因组、单独照射组和联合治疗组对EC109细胞生长均有抑制作用, 联合治疗组的抑制效应最强(39%), 且与Ad-IL-21基因组比较差异有统计学意义。结果说明, Ad-IL-21基因对EC109细胞的生长具有抑制作用, 而Ad-IL-21基因联合照射抑瘤效应最明显, 能更有效地抑制肿瘤细胞的生长。抑制肿瘤细胞生长的机理与细胞周期阻滞作用有关[9], 如果细胞提前从G1期进入S期, 细胞分裂则加快, DNA损伤修复不完全, 进而导致肿瘤发生; 如果G1期细胞增加使转入S期的细胞减少, 则肿瘤细胞的DNA合成受到抑制, 从而影响肿瘤细胞的分裂和增生。我们发现, Ad-IL-21基因组、单独照射组和联合治疗组EC109细胞停留在G1期的细胞增加, G2期和S期细胞减少, 联合治疗组G1期细胞所占比例最高, 达到71.2%, 表明IL-21基因有助于细胞保持在静止期, 有效的抑制肿瘤细胞的异常增生。本实验为食管癌的进一步基因治疗研究提供了理论基础和实验依据。
| [1] |
Weichselbaum RR, Hallahan DE, Sukhatme VP, et al. Gene therapy targeted by ionizing radiation[J]. Int J Radiat Oncol Biol Phys, 1992, 24(3): 565. DOI:10.1016/0360-3016(92)91075-X |
| [2] |
Parrish-Novak J, Dillon SR, Nelson A, et al. Interleukin 21 and its receptor are involved in NK cell and regulation of lymphocyte function[J]. Nature, 2000, 408(8): 57-63. |
| [3] |
De Groot-Kruseman HA, Klepper M, Mol WM, et al. Intragraft mRNA expression of the novel cytokine IL-21 during acute rejection after clinical heart transplantation[J]. J Heart Lung Transplant, 2003, 21(2): 165. |
| [4] |
Vollmer TL, Liu R, Price M, et al. Differential effects of IL -21 during initiation and progression of autoimmunity against neuroantigen[J]. J Immunol, 2005, 174(5): 2 696-2 701. DOI:10.4049/jimmunol.174.5.2696 |
| [5] |
Ma HL, Whitters MJ, Konz RF. IL-21 activates both innate and adaptive immunity to generate potent antitumor responses that require perforin but are independent of IFN - gamma[J]. J Immunol, 2003, 171(2): 608-615. DOI:10.4049/jimmunol.171.2.608 |
| [6] |
Asao R, Kudo T, Makabe K, et al. Antitumor activity of interleukin 21 prepared by novel refolding procedure from inclusion bodies expressed in Escherichia coli[J]. FEBS Lett, 2002, 528(1-3): 70-76. DOI:10.1016/S0014-5793(02)03254-4 |
| [7] |
王芹, 李进, 王颖嫒, 等. 人IL-21cDNA的克隆及重组腺病毒表达载体的构建[J]. 广西医科大学学报, 2009, 26(4): 516-518. DOI:10.3969/j.issn.1005-930X.2009.04.008 |
| [8] |
Dou J, Chen G, Wang J, et al. Preliminary study on mouse interleukin-21 application in tumor gene therapy[J]. Cell Mol Immunol, 2004, 1(6): 461-466. |
| [9] |
Davis ID, Skak K, Smyth MJ, et al. Interleukin-21 signaling functions in cancer and autoimmunity[J]. Clin Cancer Res, 2007, 13(23): 6 926-6 932. DOI:10.1158/1078-0432.CCR-07-1238 |
| [10] |
Jin H, Carrio R, Yu A, et al. Distinct activation signals determine whether IL-21 induces B cell costimulation, growth arrest, or B in-dependent apoptosis[J]. The Journal of Immunology, 2004, 173(1): 657-665. DOI:10.4049/jimmunol.173.1.657 |
| [11] |
Sun A, Bagella L, Tutton S, et al. From G0 to S phase:A view of the roles played by the retinoblastoma (Rb) family members in the Rb-E2F pathway[J]. J Cell Biochem, 2007, 102(6): 1 400-1 404. DOI:10.1002/(ISSN)1097-4644 |