恶性胶质瘤是指WHO分级Ⅲ~Ⅳ级胶质细胞瘤, 也称其为高分级胶质瘤, 是最常见的成年原发性脑恶性肿瘤, 占原发性中枢神经系统肿瘤的近30%, 占星形细胞瘤的50%~60%。脑恶性胶质瘤浸润性强, 手术切除率低, 多数情况下难完全切除, 且单纯手术后几乎毫无例外地出现复发。术后放疗不但可以延长局部肿瘤复发间隔时间, 而且术后放疗者具有明显的生存优势[1], 因此, 术后放疗是脑恶性胶质瘤的标准治疗手段。依据脑恶性胶质瘤的浸润特点, 并考虑到脑干等剂量限制性器官的保护和全脑受照剂量的控制, 脑恶性胶质瘤放疗过程中需要瘤床补量, 以提高高复发风险区照射剂量, 本研究对同期加量调强放疗(simultaneous integrated boost intensity-modulated radiotherapy, SIB-IMRT)与序贯加量适形放疗(sequantial boost conformal radiotherapy, SB-CRT)两种瘤床加量方式治疗计划中不同参数的剂量学进行了比较。
1 材料与方法 1.1 病例资料选择2009年2月至6月住院放疗的10例脑恶性胶质瘤术后患者, 男6例, 女4例, 中位年龄56岁(28~67岁), 肿瘤位于左侧7例(额叶2例、颞叶2例、顶叶2例、小脑1例), 右侧3例(颞叶、顶叶、枕叶各1例)。WHO分级Ⅲ5例、Ⅳ5例。术后MRI检查均有残留。
1.2 体位固定与图像获得患者仰卧于适配枕头的头部固定架上, 热塑膜固定, 4.5mm层厚增强CT连续扫描, 获取CT模拟定位图像。在相同固定体位下行增强MRI扫描, 获得MRI图像。将CT和MRI图像均传输至Pinnacle3计划系统工作站, 将CT与MRI图像融合, 在MRI图像上勾画靶区。
1.3 靶区规划将瘤床(包括术腔和术后残留病灶)定义为肿瘤靶区(gross tumor volume, GTV), GTV外放10mm定义为临床靶区1(clinical target volume, CTV1), GTV外放25mm定义为临床靶区2(CTV2), CTV1和CTV2各外放5mm分别定义为计划靶区1(planning target volume, PTV1)和计划靶区2(PTV2)。
1.4 计划设计在靶区完全相同的情况下, 应用Pinnacle3计划系统为每例患者分别制定SIB-IMRT和SB-CRT两个放疗计划。SIB-IMRT剂量分割:PTV2处方剂量2.0Gy/次× 25次, 同步给与PTV1处方剂量为2.5Gy/次× 25次。SB-CRT剂量分割:序贯制定两个CRT计划, 即(1) PTV2处方剂量2.0Gy/次× 25次, (2) PTV1处方剂量2.0Gy/次× 8次, 然后将计划(1)和(2)整合为一个完整的计划, 即形成PTV2处方剂量2.0Gy/次× 25次后序贯PTV1处方剂量2.0Gy/次× 33次的SB-CRT计划, 并显示整合形成的SB-CRT计划的剂量体积直方图(dose volume histogram, DVH)。
1.5 计划比较选择SIB-IMRT和SB-CRT计划中PTV1的最大剂量(PTV1max)及平均剂量(PTV1mean)、PTV2的平均剂量、脑干的最大剂量(BSmax)与平均剂量(BSmean)、全脑的平均剂量(WBmean)以及左右晶体最大剂量(LENS-Lmax, LENS -Rmax)和左右视神经的最大剂量(OPT-Lmax、OPT-Rmax)进行比较, 并比较两个计划中PTV1的适形指数(conformity index, CI)、异质性指数(heterogeneity index, HI)。
CI=(Vptv ≥ p/Vptv) × (Vptv ≥ p/Vp), 其中Vptv ≥ p是指PTV内接受≥处方剂量的体积, Vptv是指PTV的体积, Vp是指处方剂量的等剂量线所包括的体积。CI越接近于1代表适形性越好。
HI=D5%/D95%, 其中D5%是PTV内剂量从高到低的高剂量5%体积区域接受的最低剂量, D 95%的定义与此类似。HI越接近于1代表异质性越小。
1.6 统计学处理应用SPSS11.5统计软件包, 对不同参数两计划间比较行配对t检验, 以P<0.05为有统计学显著性差异。
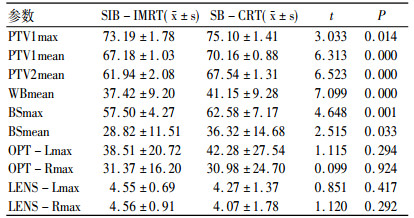
2 结果 2.1 不同参数剂量比较与SB-CRT相比, SIB-IMRT降低了全脑及脑干的剂量, 差异有统计学意义; 而晶体和视神经的剂量差异则无统计学意义。结果详见表 1。
|
|
表 1 SIB-IMRT与SB-CRT计划不同参数剂量比较(剂量单位:Gy) |
如表 2所示, 与SB-CRT相比, SB - IMRT提高了PTV1的CI和HI值, 两者的差异有统计学意义。
|
|
表 2 SIB-IMRT与SB-CRT计划靶区CI及HI比较 |
近半个世纪以来, 脑胶质瘤的诊断和治疗发展很快, 在治疗方面, 手术与放疗、化疗结合, 已成为脑恶性胶质瘤的规范化治疗方案, 其中术后放疗在脑恶性胶质瘤的治疗中占重要地位, 术后放疗可延长患者的生存期[1, 2]。脑恶性胶质瘤的α/β值为9.32[3], 对放疗不敏感, 增大单次剂量分割可能会获益。本研究采用SIB-IMRT方式, 将高复发风险区(PTV1)处方剂量设为2.5Gy/次, 总量达到62.5Gy/25次, 生物效应剂量(bio logical effetive dose, BED)与SB-CRT计划实施PTV1处方剂量66.0Gy/33次相当, 而且SIB-IMRT的实际临床效应可能优于等效生物剂量相同的SB-CRT。
脑恶性胶质瘤患者术后放疗早期采用全脑放疗, 现在多采用三维适形放疗(3D-CRT)或调强放疗(IMRT)实施瘤床(术腔)外扩相应边界的局部照射[4], 尽可能提高靶区的治疗剂量, 并减少或限制颅内正常组织器官的照射。局部照射的循证依据为脑恶性胶质瘤术后复发模式, 即多数复发发生在原肿瘤边缘2cm范围内[5], 因此, 脑恶性胶质瘤术后3D-CRT或IMRT的GTV定义为残留肿瘤和术腔, 而CTV则定义为GTV外扩20 ~25mm, 在CTV基础上综合考虑摆位误差等导致靶区位移的因素外扩约5mm形成PTV。本研究采用CT与MRI图像融合配准方法, 保证了GTV勾画与确定的准确性, 而且将GTV分别外扩15mm和30mm形成不同外扩边界的PTV1和PTV2并给与不同的总照射剂量, 肿瘤边界外不同距离给与不同剂量梯度的照射有利于局部肿瘤控制。
如上所述, 基于脑恶性胶质瘤复发模式确定PTV外放边界达到了30mm, 以此PTV制定治疗计划的过程中限制晶体、视神经、脑干及全脑的照射剂量与允许范围内往往比较困难, 因此, 探讨更为合理的治疗计划, 在提高靶区有效剂量的同时降低剂量限制性器官组织的照射剂量是必要的。我们的研究已经证明, SIB-IMR治疗脑转移瘤时较SB-CRT有剂量学优势[6], 而本研究结果同样显示, SIB-IMRT治疗脑恶性胶质瘤较SB - CRT也具有剂量学优势, 在SIB-IMRT计划中脑干的最大剂量和平均剂量均显著低于SB-CRT, 全脑的平均剂量也显著低于SB-CRT, 表明SIB-IMRT对全脑及脑干的保护优于SB-CRT。
SIB-IMRT的突出优势是瘤床同步增量, 即针对不同靶区同时实施不同处方剂量照射, 从而使肉眼肿瘤或高复发风险区获得相对较高的分次剂量并在较短的疗程中获得较高的总生物效应剂量, 除此之外, 本研究还显示, SIB-IMRT计划中PTV1的CI和HI均明显优于SB-CRT。在正常器官耐受的范围内, SIB-IMRT还有进一步提高靶区剂量的可能性, 从而提高局部控制率并为生存期的延长创造条件[2, 7], 尽管有些文献报道IMRT增量照射没有延长生存期, 但可以降低正常组织及危及器官的并发症, 提高生存质量[8-11];
尽管目前已经明确放化疗结合治疗延长了脑恶性胶质瘤患者的中位生存期, 提高了5年生存率, 但多数患者的预期生存时间仍然较短, 因此, 采用合理的放疗技术减少或限制颅内关键器官受照剂量是重要的研究方向, 已有研究报道IMRT可以更好的保护脑干等重要器官, 同时降低全脑的平均剂量[12], 但该研究没有考虑瘤床加量, 而本研究显示, 瘤床加量时, SIB-IMRT相关参数的剂量学显著优于SB-CRT。SIB-IMRT是否会具有局部肿瘤控制及生存优势还有待于观察。
| [1] |
Laperriere N, Zuraw L, Cairncross G, et al. Radiotherapy for newly diagnosed malignant glioma in adults:a systematic review[J]. Radiother Oncol, 2002, 64(3): 259-273. DOI:10.1016/S0167-8140(02)00078-6 |
| [2] |
Tsien C, Moughan J, Michalski JM, et al. Phase Ⅰ three-dimensional conformal radiation dose escalation study in newly diagnosed glioblastoma:Radiation Therapy Oncology Group Trial 98-03[J]. Int J Radiat Oncol Biol Phys, 2009, 73(3): 699-708. DOI:10.1016/j.ijrobp.2008.05.034 |
| [3] |
Jones B, Sanghera P. Estimation of radiobiologic parameters and equivalent radiation dose of cytotoxic chemotherapy in malignant glioma[J]. Int J Radiat Oncol Biol Phys, 2007, 68(2): 441-448. DOI:10.1016/j.ijrobp.2006.12.025 |
| [4] |
Deye J, Abrams J, Coleman N. The National Cancer Institute. Guidelines for the use of intensity-modulated radiation therapy in clinical trials[J]. NCTD NCI, 2005, 1-14. |
| [5] |
Hess CF, Schaaf JC, Kortmann RD, et al. Malignant glioma: patterns of failure following individually tailored limited volume irradiation[J]. Radiother Oncol, 1994, 30(2): 146-149. DOI:10.1016/0167-8140(94)90044-2 |
| [6] |
邵倩, 孙涛, 李建彬, 等. 多发脑转移瘤同期加量适形调强与序贯适形放疗计划不同剂量参数比较[J]. 中华放射医学与防护杂志, 2009, 29(4): 410-411. DOI:10.3760/cma.j.issn.0254-5098.2009.04.017 |
| [7] |
Arslan M, Karadeniz AN, Aksu G, et al. Postoperative hypo-fractionated radiotherapy in glioblastoma multiforme[J]. J BUON, 2006, 11(1): 39-42. |
| [8] |
Hermanto U, Frija EK, Lii MJ, et al. Intensity-modulated radiotherapy (IMRT) and conventional three-dimensional conformal radiotherapy for high-grade gliomas:does IMRT increase the integral dose to normal brain?[J]. Int J Radiat Oncol Biol Phys, 2007, 67(4): 1 135-1 144. DOI:10.1016/j.ijrobp.2006.10.032 |
| [9] |
Narayana A, Yamada J, Berry S, et al. Intensity-modulated radiotherapy in high-grade gliomas:clinical and dosimetric results[J]. Int J Radiat Oncol Biol Phys, 2006, 64(3): 892-897. DOI:10.1016/j.ijrobp.2005.05.067 |
| [10] |
MacDonald SM, Ahmad S, Kachris S, et al. Intensity modulated radiation therapy versus three-dimensional conformal radiation therapy for the treatment of high grade glioma:a dosimetric comparison[J]. J Appl Clin Med Phys, 2007, 8(2): 47-60. DOI:10.1120/jacmp.v8i2.2423 |
| [11] |
Nakamatsu K, Suzuki M, Nishimura Y, et al. Treatment outcomes and dose-volume histogram analysis of simultaneous integrated boost method for malignant gliomas using intensity -modulated radiotherapy[J]. Int J Clin Oncol, 2008, 13(1): 48-53. DOI:10.1007/s10147-007-0722-6 |
| [12] |
卢洁, 吴朝霞, 张桂芳, 等. 脑胶质瘤三维适形放射治疗与调强放射治疗的剂量学比较[J]. 中华放射医学与防护杂志, 2009, 29(5): 499-501. DOI:10.3760/cma.j.issn.0254-5098.2009.05.011 |