2. 中国医学科学院放射医学研究所天津市分子核医学重点实验室, 天津 300192
2. Key Laboratory of Molecular Nuclear Medicine, Institute of Radiation Medicine, Chinese Academy of Medical Sciences and Peking Union Medical College, Tianjin 300192 China
宫颈癌是最常见的妇科恶性肿瘤之一, 治疗方法以手术、化疗、放疗为主, 但是5年生存率仍然较低。放射治疗是临床上应用最广泛和最重要的治疗手段之一, 但由于肿瘤临近部位的正常组织受到放射损伤和某些肿瘤的辐射抗拒性等问题, 影响着放疗的疗效和应用。肿瘤的基因治疗是近年来的研究热点, 它是将对肿瘤有直接和间接杀伤作用的基因经载体转入体内, 以期在肿瘤生长部位进行表达, 杀伤肿瘤, 但其临床疗效并不令人满意。利用辐射来实现对转移基因体内表达的时空调控, 可以提高基因靶向转移的效率, 同时基因能够提高肿瘤对放射治疗的敏感性, 有效地将基因治疗与放射治疗有机结合起来, 发挥协同效应, 这种新治疗模式称为基因放疗(genetic-ra-diotherapy)[1], 已成为肿瘤治疗研究的重要方向之一。本研究用含人IL-21基因的重组腺病毒表达载体(Ad-IL-21)感染宫颈癌Hela细胞, 并进行γ射线照射, 观察IL-21基因联合放射对宫颈癌细胞生长作用的影响, 探讨其联合抑瘤作用, 为临床上进行IL-21基因-放射治疗肿瘤奠定实验基础。
1 材料与方法 1.1 细胞系及培养条件人子宫颈癌Hela细胞由中国医学科学院放射医学研究所惠赠, 用含10%小牛血清的RPMI1640培养基, 置5% CO2、饱和湿度、37℃培养箱中培养。
1.2 主要试剂和仪器RPMI1640培养基(北京赛默飞世尔), MTT(天津华大欣源), 分析纯二甲基亚砜(天津市江天化工科技), 小牛血清(北京索莱宝科技有限公司), Ad-IL-21及对照腺病毒Ad-lacZ由中国医学科学院放射医学研究所构建保存[2]。137Cs γ射线照射源(USD, 加拿大), 酶标仪(美国Thermo公司), 流式细胞仪(美国Beckman公司, AltraⅡ)。
1.3 分组数字随机表法分为空白对照组(不做任何处理)、Ad-LacZ对照组(含lacZ基因但不含IL-21基因的对照腺病毒)、照射组(137Csγ射线照射源6 Gy照射, 剂量率为0.75 Gy/ min)和Ad-IL-21联合照射组(Ad-IL-21转染后进行6 Gy照射)
1.4 MTT法检测Hela细胞生长情况于转染前1天取对数生长期的Hela细胞, 按每孔2 × 103个细胞接种96孔板中, 转染当天按上述分组处理, 每组做6个复孔, 每孔加100ul Ad-IL-21(病毒滴度为9 × 1011 PFU/ml)。每组分别于处理后培养0、24、48、72、96h后加入0.5% MTT液20 μl, 孵育4 h后酶标仪测定492nm吸光度(A)值。绘制细胞生长曲线图, 并计算细胞生长的抑制率:抑制率(%)=(1-实验组A值/对照组A值) × 100%。
1.5 流式细胞术检测Hela细胞周期于转染前1天取对数生长期的Hela细胞按3 × 105个细胞/孔接种于6孔培养板, 转染当天按上述分组处理, 每孔加200μl Ad-IL-21 (病毒滴度为9 × 1011PFU/ml), 每组设2孔。培养48 h后收集所有悬浮及贴壁细胞, 每组用冷PBS液洗涤2次, 70%冰乙醇4℃固定1 h, -20℃保存。检测前用冷PBS液洗2次, 加入500μl碘化丙啶, 轻轻混匀, 暗处避光反应30 min, 上流式细胞仪488 nm波长检测细胞周期。
1.6 统计学分析采用SPSS13.0软件包进行统计分析, 显著性检验采用单因素方差分析, P<0.05表示差异有统计学意义。
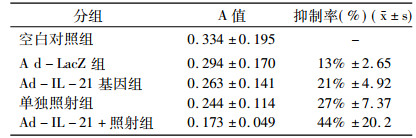
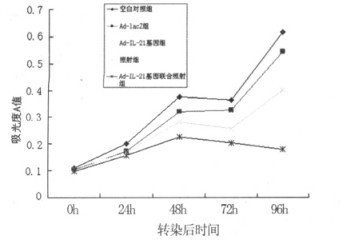
2 结果 2.1 Ad-IL-21联合照射对Hela细胞生长的影响空白对照组和Ad-lacZ组Hela细胞数量随培养时间延长呈增加的趋势, Ad-IL-21基因组于转染后96h肿瘤细胞出现明显的抑制作用, 与空白对照组和Ad-lacZ组比较差异有统计学意义(F =7.181, P<0.05), 而空白对照组与Ad-lacZ组比较无明显差异(P > 0.05)。照射组和Ad-IL-21基因联合照射组Hela细胞于转染后48h出现较明显的抑制作用, 与Ad-lacZ组和Ad-IL-21基因组比较差异有统计学意义(F=249.88, P<0.05), 尤其在转染后96 h联合组与照射组和Ad-IL-21基因组比较, 细胞生长抑制作用明显(F=42.981, P<0.05), 见图 1。
|
图 1 Ad-IL-21联合照射作用于Hela细胞的生长抑制曲线 |
IL-21基因转染Hela细胞后观察24 h、48 h、72 h、96 h细胞的生长抑制情况, Ad-IL-21基因联合照射组于转染后96 h抑制率最高, 达44%, 与Ad-IL-21基因组和单独照射组比较差异有统计学意义(P<0.05), 而Ad-IL-21基因组Hela细胞生长抑制率与单独照射组比较无明显差异(P > 0.05), 见表 1。结果提示IL-21基因对Hela细胞的生长具有抑制作用, 而IL-21基因与放射治疗联合应用具有协同效应, 能更有效地抑制肿瘤细胞的生长。
|
|
表 1 Ad-IL-21联合照射对Hela细胞的生长抑制效应 |
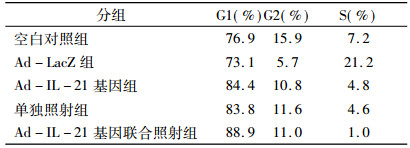
从流式细胞术分析结果可见, 与Ad-lacZ组和空白对照组相比, Ad-IL-21组、照射组及Ad-IL-21联合照射组Hela细胞停留在G1期的细胞增加, S期细胞数量减少。其中以联合照射组G1期细胞所占比例最高, 达到88.9%, S期细胞最少, 1%, 见表 2。结果表明Ad-IL-21联合照射使Hela细胞主要阻滞在G1期。
|
|
表 2 Ad-IL-21转染后Hela细胞的细胞周期 |
IL-21是近年来发现的一种细胞因子, 在早期临床研究发现IL-21在各种动物模型中具有抗肿瘤活性。Sondergaard[3]等研究发现, 在两种同基因肿瘤模型中(B16黑色素瘤和Renca肾脏细胞癌)检测到IL-21蛋白的抗肿瘤活性, 且影响肿瘤浸润T细胞(主要为CD8+ T细胞)密度。IL-21[4]主要由CD4+ Th2细胞和NKT细胞合成和分泌, 与IL-2、IL-4、IL-7、IL - 9、IL-15高度同源, 都属于r链家族细胞成员。IL-21受体分布广泛, 包括脾、胸腺、PBLs和淋巴结等淋巴器官和组织分布。Dimitra[5]等发现IL-21通过B细胞内在机制可直接刺激生发中心B细胞增殖与分化。IL-21也可以与抗CD40抗体协同刺激B细胞增殖, 与抗CD3抗体协同刺激T细胞增殖, 增强抗CD3抗体活化的T细胞的抗肿瘤活性[6], 并能促进骨髓NK细胞增殖与分化并表达CD16分子, 从而完成NK细胞的成熟分化, 使NK细胞具有细胞毒活性。Ugai[7]等发现, 将IL-21和IL-23基因转导到人胰腺癌细胞, 能产生自然杀伤细胞依赖性和非依赖性抗肿瘤效应。国内有研究报道[8], 将人IL-21基因转染卵巢癌细胞, 对细胞的生长有明显的抑制作用。
本实验采用我们成功构建的Ad-IL-21重组腺病毒载体转染宫颈癌细胞, 结合γ射线照射, 观察IL-21基因与放射两者协同抑制肿瘤的作用。为了确定腺病毒表达载体上基因的作用, 本研究以Ad-lacZ作为阳性对照, 说明此抑制作用来自IL-21基因的表达, 而不是腺病毒本身。结果表明Ad - lacZ和空白对照组比较差异均无统计学意义, 提示腺病毒本身对肿瘤生长无影响。
本结果显示, 腺病毒载体可有效的将外源性IL-21基因转入Hela细胞, 且进行γ射线照射, IL-21基因联合照射的细胞生长最为明显缓慢, 说明腺病毒介导的IL-21基因联合照射可显著抑制Hela细胞的生长。有研究指出基因治疗使肿瘤细胞阻滞于G1期, 减少进入G2期和S期的细胞, 而G1后期对放疗比较敏感, 从而提高肿瘤细胞的敏感性[9]。从理论上讲, 放疗和基因治疗两者相互加强, 可以取得比单一方法效果更好的抑瘤效果。从本实验的研究结果可以得知转染IL-21基因联合γ射线照射作用于宫颈癌Hela细胞后的效果要比单独IL -21基因组、单独照射组效果更好, 单独IL-21基因组和单独照射组两者之间没有明显的差别, 这为宫颈癌的进一步基因放疗研究提供了理论基础和实验依据。
| [1] |
Keall PJ, Lammering G, Lin PS, et al. Tumor control probability Prediction for genetic radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2003, 57(1): 255-263. DOI:10.1016/S0360-3016(03)00500-5 |
| [2] |
王芹, 李进, 王颖嫒, 等. 人IL-21cDNA的克隆及重组腺病毒表达载体的构建[J]. 广西医科大学学报, 2009, 26(4): 516-518. DOI:10.3969/j.issn.1005-930X.2009.04.008 |
| [3] |
Sondergaard H, Frederiksen KS, Thygesen P, et al. Interleukin 21 therapy increases the density of tumor infiltrating CD8+ T cells and inhibits the growth of syngeneic tumors[J]. Cancer Immunol Immunother, 2007, 56(9): 1 417-1 428. DOI:10.1007/s00262-007-0285-4 |
| [4] |
Sondergaard H, Skak K. IL-21:roles in immunopathology and cancer therapy[J]. Tissue Antigens, 2009, 74(6): 467-479. DOI:10.1111/j.1399-0039.2009.01382.x |
| [5] |
Zotos D, Conquet JM, Zhang Y, et al. IL-21 regulates germinal center B cell-differentiation and proliferation through a B cell-intrinsic mechanism[J]. J Exp Med, 2010, 207(2): 365-378. DOI:10.1084/jem.20091777 |
| [6] |
Parrish-Novak J, Dillon SR, Nelson A, et al. Interleukin 21 and its receptor are invovled in NK cell expansion and regulation of lymphocyte function[J]. Nature, 2000, 408(8): 57-63. |
| [7] |
Ugai S, Shimozato O, Yu L, et al. Transduction of the IL-21 and IL-23 genes in human pancreatic carcinoma cells produces natural killer cell-dependent and independent antitumor effects[J]. Cancer Gene Ther, 2003, 10(10): 771-778. DOI:10.1038/sj.cgt.7700630 |
| [8] |
王芹, 李进, 宋力, 等. 人IL-21基因对卵巢癌细胞生长的抑制作用[J]. 中国辐射卫生, 2009, 18(4): 396-397. |
| [9] |
Badie B, Kramar MH, Lau R. Adenovirus-mediated p53 gene delivery potentiates the radiation-induced growth inhibition of experimental brain tumors[J]. J Neurooncol, 1998, 37(3): 217-222. DOI:10.1023/A:1005924925149 |