2. 苏州大学医学部放射医学与公共卫生学院
肺癌是最常见的恶性肿瘤之一, 近年来其发病率和死亡率有逐年增加的趋势, 其中非小细胞肺癌(non-small cell lung cancer, NSCLC)大约占肺癌总数的70%~80%, 放射治疗是NSCLC重要的治疗手段, 精确放疗是目前放疗的趋势, 它使肿瘤剂量的提高成为可能, 提高了放疗在肺癌治疗中的地位。但精确放疗的实施要以准确的诊断和分期, 以及精确的靶区勾画为基础的, 因此对肿瘤的影像学诊断技术提出更高的要求。近年来迅速发展的PET显像从分子水平反映肿瘤/正常组织生化变化和代谢状态之间的差异, 能为肿瘤靶区的确定提供更多有价值的活体生物信息[1], 本研究旨在探讨PET/CT在NSCLC放疗中的应用价值。
1 材料与方法 1.1 临床资料2009年5月~2010年1月在我院核医学科进行PET/CT显像检查的NSCLC患者。选取标准为有完整病史、体检和临床分期所需的常规影像学检查资料, 显像见一到两个肿瘤病灶, 为肺癌首发伴或不伴淋巴结肿大, 既往检查未见远处转移, 具有肿瘤放射治疗适应证的患者21例, 其中男性17例, 女性4例, 年龄45~93岁, 中位年龄63岁, 均经病理学或细胞学证实为非小细胞型肺癌, 其中鳞癌10例, 腺癌11例。
1.2 方法 1.2.1 18F-FDG PET/CT检查方法PET/CT扫描仪为GE公司discovery STE-16型, 18F-FDG由GE公司Minitrace回旋加速器生产, 放化纯度> 98%, 按病人体重0.11~0.15mCi/kg静脉注射。检查前常规测患者的体重及血糖, 血糖均值5.57± 1.09。患者禁食6小时以上, 肘静脉注射18F-FDG平静休息40min后, 在平静呼吸下行CT和PET全身图像采集, 采集时间约21~22min, 扫描范围为头顶至大腿中部, 采集方式为3D采集, 重建方式采用有序子集迭代法(OS-EM)。获得的数据经计算机处理后获得CT、PET及PET/CT同机融合的冠状位、横断位及矢状位影像。
1.2.2 靶区勾画方法将PET/CT全部原始数据传到放疗科CMS治疗计划系统, 在FOCUS工作站利用Fusionl0.43融合软件进行CT和PET图像融合及三维重建。靶区定义按照ICRU50号和62号文件规定标准。CT图像上的靶区勾画由一名放射科主治医师和一名放疗科主治医师在肺窗(窗宽1700Hu, 窗位-300Hu)和纵隔窗(窗宽600Hu, 窗位40Hu)上, 对每一层CT横断图像上的病灶边界的勾画, 除外可疑肺不张、胸膜渗出、血管结构、肺炎等区域。PET/CT融合图像上的靶区勾画由一名核医学科主治医师和一名放疗科主治医师在窗宽约900Hu, 窗位约300Hu (工作站图像与PET/CT显像标准摄取值SUV > 2.5以上的图像基本一致)上完成, 如两个或更多病灶距离0.5cm以上, 则分别勾画。
1.3 分期方法按UICC国际抗癌联盟1997年分期标准分期, CT图像上凡淋巴结短径≥ 10mm视为异常, < 10mm视为正常, 但若是淋巴结 < 10mm, 其中心存在坏死, 或见到相互融合的淋巴结, 也诊断为纵隔淋巴结转移; 对其它转移的诊断结合病灶密度和形态改变来具体分析。PET图像以SUV ≥ 2.5作为恶性肿瘤或远处转移的判断标准。
1.4 统计学方法应用统计软件包SPSS 10.0系统进行统计学分析, 数据以x珋±s表示, 组间比较采用t检验, P < 0.05为差异具有统计学意义。
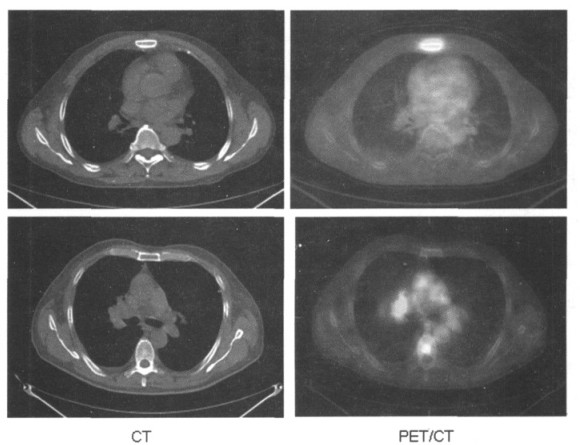
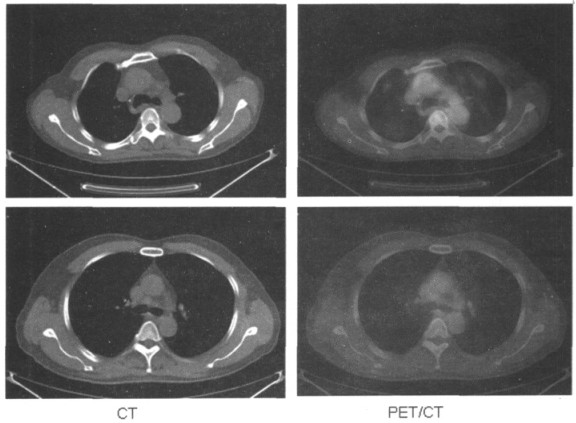
2 结果 2.1 分期改变52.38%(11/21例)入组患者分期改变, 分期升级的有7例:N分期升级4例(见表 1), M分期升级的2例(见图 1), T分期升级2例; 分期降级的有4例:从T2降到T1的1例, N级降级3例(见图 2)。
|
|
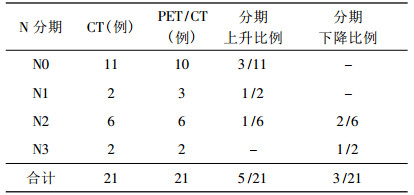
表 1 PET/CT和CT对N分期的比较 |
|
图 1 骨转移CT及PET-CT检查结果比较 |
|
图 2 纵隔淋巴结CT及PET-CT检查结果比较 |
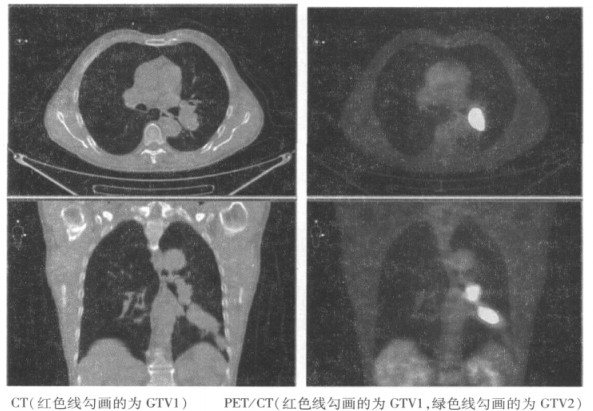
21例患者GTVCT和GTVPET/CT均不相同, 6例GTVPET/CT大于GTVCT, 平均增大40.47%, 在PET/CT上肺部原发灶的体积也均增大(0.1~18.7 cm3)。15例GTVPET/CT小于GTVCT, 平均缩小31.38%, 在PET/CT上肺部原发灶的体积也均缩小(0.6~55.7cm3), P < 0.05。见图 3。
|
图 3 CTVCT及CTVPET-CT比较 |
增强CT是目前NSCLC放疗前定位的最常用的检查方法, 但由于NSCLC原发肿瘤侵入软组织、肺不张或肺实变与原发灶紧密相连时肿瘤边界均很难确定, 纵隔淋巴结转移亦是诊断难点。因此, CT确定的分期准确性较低, 为临床提供依据的可靠性也较低。18F-FDG PET可以从人体代谢方面反映病变的性质, 因为病变组织的代谢变化要早于形态学变化, 因此其在病变的定性诊断上具有更高的灵敏度, 对病变的良恶性鉴别较CT有明显的优势。但PET显像的不足之处在于图像空间分辨率低, 解剖结构显示不良, 无法对病灶进行准确定位[2]。18F -FDG PET/CT显像保留了18F-FDG PET的上述优点, 同时还有CT空间分辨率和密度分辨率较高的优点, 同机采集和图像融合可以在疾病早期同时反映肿瘤的代谢变化和形态学改变, 因此, 理论上通过该技术可以明确NSCLC的解剖结构, 正确判断肿瘤与正常组织的关系, 鉴于此, 我们开展了该研究, 来探讨探讨PET/CT在NSCLC放疗中的应用价值。
通常情况下, CT仅能根据直径大小区分是否为转移淋巴结, 但约有30%~40%的淋巴结不遵循CT诊断淋巴结转移的规律, 即肿大的淋巴结不一定是转移, 转移的淋巴结不一定都体积增大[2]。因此, 对于判断纵隔淋巴结转移情况, PET/CT显示纵隔淋巴结的精确性达80%~100%[3], 要明显优于CT的55%[4], 主要体现在:①隆突下和主肺动脉窗易出现较大的正常淋巴结, CT单纯根据体积大小难以判断是否转移; ②CT对结构复杂部位如食管旁和肺韧带区域淋巴结, 或者周围缺乏脂肪组织对比时显示欠清晰。我们的研究结果表明, PET/CT显像较CT多发现了7个转移淋巴结, 这7个淋巴结在CT上体积较小, 未达到诊断标准, 而这多发现的7个淋巴结使得4例患者N分期升级; 同时PET/CT排除了CT上的5个直径均大于10 mm的肿大淋巴结, 使3例N分期降级, 虽然以上患者的放疗方案未改变, 但随着分期变化, 靶区和放疗剂量做出了相应调整。可见, PET/CT能检出在CT上看来是正常大小的转移淋巴结, 从而避免靶区遗漏, 提高控制率; 也能排除CT诊断为转移的、因其他原因而增大的淋巴结, 从而可缩小照射体积, 降低放疗相关并发症的发生几率和严重程度。
18F-FDG PET能准确地将NSCLC病人分为局部侵犯和远处转移两类, 尤其在诊断骨与软组织转移具有优势[5]。PET显像从葡萄糖代谢变化的角度显示骨转移瘤, 对仅限于骨髓内而尚未引起成骨或溶骨反应的骨转移瘤可清楚地显示出来, 因此, 本研究中我们在PET/CT融合图像阅片时, 除了肿瘤原发灶清晰显影外, 还分别发现了这两个患者的椎体和胸骨均见FDG高浓聚灶, 判定为骨转移, M0均升级至M1, 说明PET/CT能灵敏地检出CT上无法显示的早期骨转移, 从而调整治疗策略, 从根治性放疗改为姑息性放疗。
勾画靶区是制定放疗计划的关键步骤。靶区勾画存在误差, 将直接影响到NSCLC的治疗效果和放射性肺炎的发生及其严重程度。本研究中, 所有病例的GTVPET/CT与GTVCT均有改变。在6例GTVPET/CT大于GTVCT (平均增大40.47%)中, GTV增大最多的达100%, 原因是在PET/CT融合图像上除了原有病灶显影清晰, 修正了靶区边界外, 还新增加了靶区, 多发现了胸壁侵犯, 胸骨和淋巴结转移等。本研究中一例患者PET/CT图像上原CT图像拟诊肺不张部位病灶中部见FDG浓聚灶, 边界清晰, 周围肺不张部位未见明显放射性摄取, 靶区明显增大。在15例GTVPET/CT小于GTVCT (平均缩小31.38%)的患者中, 有些是排除了在CT图像上肿大的转移淋巴结, 去除了假阳性病灶。有些是原发肿瘤灶边界大大缩小, 虽然同时较CT多发现其他转移灶, 但总体积仍然是缩小了。本研究中有1例患者显像前行2次化疗, 化疗前后的CT图像对比肿瘤范围未见明显变化, 但PET/CT上肿瘤部位FDG浓聚灶明显小于CT图像, 因此靶区体积较CT明显缩小。肿瘤经过一段时间的治疗后, 病灶开始坏死液化、纤维化等, 此时代谢会进一步减低, 但它的形态却变化不大, 等到其形态发生明显的改变, 大约需要1~3个月的时间, 因此解剖结构变化明显滞后于代谢功能的改变, 而PET/CT能利用FDG代谢很好地反映出尚存活的肿瘤细胞, 能更好地指导治疗计划的制定。这一结果与Hanna[6]和Gondi[7], Deniaud-Alexandre[8]等的研究结果相一致。
综上所述, PET/CT将形态学与功能图像相融合, 使两种影像学检查的信息能够互补, 明显提高非小细胞肺癌的诊断、分期的准确度, 更精确的显示肿瘤靶区与正常组织的关系, 为放射治疗个体化设计提供了可靠依据, 有助于指导制定放疗方案, 减少放射性肺炎的发生, 提高生存率及生存质量, 从而真正发挥出精确放疗的优势。
| [1] |
Gregoire V, Haustermans K, Geets X, et al. PET-based treatment planning in radiotherapy:a new standard[J]. J Nucl Med, 2007, 48(Suppl 1): 68s-77s. |
| [2] |
Ford EC, Herman J, Yorke E, et al. 18 F-FDG PET/CT for image-guided and intensity-modulated radiotherapy[J]. J Nucl Med, 2009, 50(10): 1655-1665. DOI:10.2967/jnumed.108.055780 |
| [3] |
Fischer B, Lassen U, Mortensen J, et al. Preoperative staging of lung cancer with combined PET-CT[J]. N Engl J Med, 2009, 361(1): 32-39. DOI:10.1056/NEJMoa0900043 |
| [4] |
Sioris T, Jarvenpaa R, Kuukasjavi P, et al. Comparison of computed tomography and systematic lymph node dissection in determining TNM and stage in non-small cell lung cancer[J]. Eur J Cardiothorac Surg, 2003, 23(3): 403-408. DOI:10.1016/s1010-7940(02)00806-0 |
| [5] |
Levine M, Julian J. Imaging:PET-CT imaging in non-small-cell lung cancer[J]. Nat Rev Clin Oncol, 2009, 6(11): 619-620. DOI:10.1038/nrclinonc.2009.163 |
| [6] |
Hanna GG, McAleese J, Carson KJ, et al. 18 F-FDG PET-CT simulation for non-small-cell lung cancer:effect in patients already staged by PET-CT[J]. Int J Radiat Oncol Biol Phys, 2010, 77(1): 24-30. DOI:10.1016/j.ijrobp.2009.04.045 |
| [7] |
Gondi V, Bradley K, Mehta M, et al. Impact of hybrid fluorodeoxyglucose positron-emission tomography/computed tomography on radiotherapy planning in esophageal and non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2007, 67(1): 187-195. DOI:10.1016/j.ijrobp.2006.09.033 |
| [8] |
Deniaud-Alexandre E, Touboul E, Lerouge D, et al. Impact of computed tomography and 18 F-deoxyglucose coincidence detection emission tomography image fusion for optimization of conformal radiotherapy in non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2005, 63(5): 1432-1441. DOI:10.1016/j.ijrobp.2005.05.016 |