2. 山东省鄄城县闫什计生站;
3. 山东大学附属省立医院肿瘤治疗中心
肝癌是威胁人类的常见病, 也是人类生命的主要"杀手之一。传统的放、化疗存在抗肿瘤能力低、杀伤指数过小、副作用大等缺点。人钠/碘同向转运体(human sodium/iodide symporter, hNIS)主要存在于甲状腺滤泡细胞基底膜上, 是甲状腺细胞摄取碘的分子基础。hNIS基因的克隆成功, 使hNIS基因介导放射性核素进行肿瘤的基因治疗成为国内外的研究热点之一, 但在肝癌治疗中少有报道。本研究将hNIS基因转染到肝癌细胞, 使肝癌细胞表达hNIS这种膜蛋白, 从而使肝癌细胞可以浓集放射性碘, 进而介导放射性碘杀伤肝癌细胞, 为探索肝癌治疗新途径提供了实验依据。
1 材料与方法 1.1 材料 1.1.1 菌株、载体、细胞和组织大肠杆菌DH5α、pCDNA3.1(-)载体、肝癌细胞株HepG2由本实验室保存。甲状腺山东省肿瘤医院提供。
1.1.2 主要试剂TRlzol购自Invitrogen公司; RT-PCR试剂盒, DL2000, PMD18-T载体, 限制性内切酶BamHⅠ、EcoRⅠ, T4 DNA Ligase均购自TaKaRa公司; Agarose购自BIOWEST公司; Gel Extraction Kit和Plasmid Mini Kit购自OMEGA公司。DMEM培养基购自GIBCO公司, 胎牛血清购自杭州四季青公司, 其他生化试剂均为进口或国产分析纯试剂。
1.2 方法 1.2.1 总RNA提取按照TRlzol说明书提取甲状腺中总RNA。
1.2.2 引物设计根据GenBank人类hNIS的cDNA基因序列, 利用Primer Premier5.0软件设计相应的PCR扩增引物, 见下表 1。其中, hNIS基因序列的大小为1913bp, 且为便于后续定向克隆正反义引物5'端分别加EcoRⅠ与BamHⅠ酶切位点修饰(下划线)。然后, 于GenBank上进行BLAST比对检测其特异性。引物为上海博尚公司合成。
|
|
表 1 本实验研究设计的引物 |
于DEPC处理过0.2ml Eppendorf管中, 以甲状腺提取总RNA为模板, 按照RT-PCR反应试剂盒说明书, 反转录克隆hNIS基因。PCR产物进行1%琼脂搪凝胶电泳检测扩增结果。
1.2.4 真核表达载体的构建凝胶回收hNIS的PCR产物, 连入pMD18-T载体(命名为pMD-hNIS)。连接产物转化DH5α感受态细胞, 涂布于100mg/L氨苄青霉素(Amp)琼脂LB平板, 37℃过夜培养。挑取单菌落, 于100mg/LAmp液体LB培养基37℃过夜摇菌。Plasmid Mini Kit提取质粒, 通过PCR和酶切验证。
1.2.5 hNIS连入pCDNA3.1(-)载体用限制性内切酶EcoRⅠ与BamHⅠ分别双酶切pMD-hNIS和pCDNA3.1(-)质粒, 37℃孵育4h后, 酶切产物进行1%琼脂糖凝胶电泳检测酶切结果。将回收的目的基因hNIS与线性载体pCDNA3.1(-)按摩尔数之比3:1混合, 16℃过夜, 重组载体命名为pCDNA-hNIS。
1.2.6 重组载体的鉴定以pCDNA-hNIS重组载体为模板, 利用相对应的引物对扩增hNIS, 进行PCR产物电泳鉴定。用限制性内切酶EcoRⅠ与BamHⅠ双酶切重组载体, 酶切产物电泳鉴定。
1.2.7 细胞培养DMEM加10%FBS培养HepG2细胞, 每3天换液1次, 0.25%的胰酶消化传代, 显微镜下观察。
1.2.8 细胞转染参考脂质体lipofecamine2000说明书, 在24孔板中进行。每孔用脂质体2μl, 质粒pCDNA-hNIS0.8μg, 转染72h后, 胰酶消化1:10传代, 加800μg/mLG418筛选, 直至转染细胞克隆的形成, 并对克隆细胞株进行扩增培养。
1.2.9 稳定转染细胞的鉴定克隆细胞株扩增培养后用分别提取总蛋白, 利用人钠/碘同向转运体抗体进行Western blot鉴定。
1.2.10 转染细胞摄碘能力的测定我们把稳定表达人NIS的HepG2细胞和对照组(没有转入人NIS的HepG2细胞)分别用3.7MBq/ml的Na-I131的HBSS溶液培养7h, 用HBSS溶液反复冲洗细胞3次, 分别用γ计数仪测定两组细胞的每分钟cpm计数。, 以测定转染细胞吸碘能力。
1.2.11 MTT实验选取1×103个稳定表达的细胞接种于96孔板, 加入碘-131后培养7h, 用HBSS溶液清洗3次, 继续培养1、2、3、4、5d, 用快速翻转法倒掉原培养基, 每孔加入无血清的DMEM培养液200μl及5mg/ml的四氮唑蓝盐[3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazoliumbromide, MTT]20μl, 继续培养4h, 吸出液体, 每孔加入二甲基亚砜(dimethyl sulfoxide, DMSO)150μl, 室温孵育10min, 微振荡器振荡15min, 用Bio-Rad酶联免疫检测仪在570nm测光密度值。1.2.12统计学处理检测结果用SPSS13.0统计软件t检验方法进行统计分析。
2 结果 2.1 总RNA提取从甲状腺提取的总RNA, 经过微量核酸定量仪检测OD260/OD280=1.85。
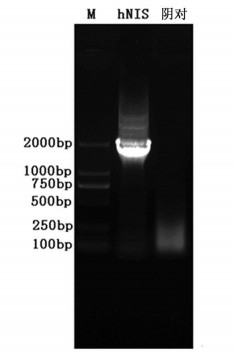
2.2 hNIS的克隆以提取RNA为模板反转录得到cDNA, 以cDNA为模板利用表 1中hNIS引物对进行PCR扩增, PCR产物进行1%琼脂搪凝胶电泳检测扩增得到图 1, 得到的片段大小与已知的一致。
|
图 1 hNIS的RT-PCR电泳图 泳道M:DL2000 marker; hNIS:hNIS (1913bp); 阴对:阴性对照。 |
以pCDNA-hNIS重组载体为模板, 利用表 1中hNIS引物对扩增hNIS片段, 同时设阴性对照组, PCR产物进行1%琼脂搪凝胶电泳检测扩增得到图 2, 得到的片段大小与已知的一致。

|
图 2 重组载体PCR电泳图 泳道M:DL2000 marker; 样品:hNIS (1913bp); 阴对:阴性对照。 |
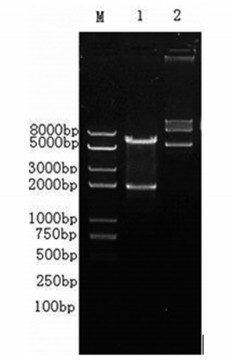
用限制性内切酶EcoRⅠ与BamHⅠ双酶切pCDNA-hNIS重组载体, 同时设阴性对照组。切下的小片段为hNIS基因(1913bp), 大片段为载体pCDNA(5.4kb)。酶切产物电泳鉴定进行1%琼脂搪凝胶电泳得到图 3, 得到的片段大小与已知的一致。
|
图 3 重组载体酶切电泳图 泳道M:DL2000 plusmarker; 1:pCDNA-hNIShNIS(1913bp); 2:未酶切pCDNA-hNIS |
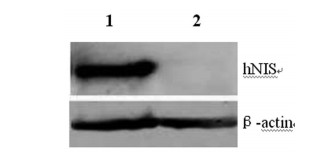
hNIS蛋白表达情况, 结果显示hNIS在细胞株中稳定表达(图 4)。
|
图 4 Westernblot方法鉴定hNIS的表达 |
测定结果转染NIS的细胞γ计数为(4260±232)min-1, 对照组γ计数为(360±36)min-1, 实验组吸碘能力高于对照组10倍, 两者差异具有显著统计学意义(P < 0.001)。
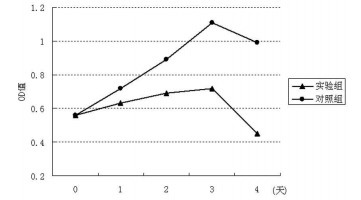
2.7 碘131对肝癌细胞的杀伤作用碘-131细胞作用后, 与稳定转染空白载体组相比, hNIS基因转染组细胞的1d、2d、3d、4d抑制率分别为12.5%、22.5%、35.1%、54.5%(图 5)。
|
图 5 MTT法测定碘131对肝癌的杀伤作用 |
放射性碘是治疗恶性肿瘤的手段之一, 但放射性碘发挥杀伤肿瘤细胞效应的基础是肿瘤细胞必须具有摄取碘的能力。但是大多数恶性肿瘤摄取碘的能力普遍较低[1-4], 使放射性碘治疗难以发挥治疗作用。hNIS主要存在于甲状腺滤泡细胞基底膜上, 属于钠/葡萄糖协同转运体家族。它对碘的主动运输使甲状腺内的碘浓度高于血浆20~40倍, 被称为"碘泵"[5, 6], 是甲状腺细胞摄取碘的分子基础。DaiG等[5]于1996年首先发表了对大鼠钠/碘同向转运体(rNIS)基因的克隆结果。在此基础上, 同年, Smanik PA等[6]从rNIS基因核苷酸序列获得引物, 以人滤泡性甲性腺癌细胞的RNA为模板, 通过聚合酶链反应(PCR)法获取了人钠/碘同向转运体(hNIS)的cDNA片段, 并进而从人甲状腺细胞cDNA文库中分离出hNIS基因。
hNIS基因的克隆成功, 使肿瘤细胞转染hNIS基因, 使其具有摄碘功能, 进一步通过应用放射性碘杀伤肿瘤细胞成为可能。相继有文献对放射性碘杀伤肿瘤细胞进行了报道。如用逆转录病毒[7]或腺病毒[8, 9]为载体将NIS基因转入黑色素瘤、卵巢肿瘤细胞、人胶质瘤细胞、结肠癌细胞, 实验显示转染肿瘤细胞碘摄取显著增加, 将转染后的人黑素瘤细胞注射到裸鼠后肢腹侧, 经放射性碘治疗后, 有56%~69%的肿瘤细胞被杀死。以上研究提示了通过基因转染的方法治疗肿瘤的可行性。
Spitzweg[10]等在体外构建了以前列腺特异性抗原为启动子指导NIS基因表达的前列腺癌细胞株(LNCaP), 将其接种于无胸腺裸鼠皮下, 建立了表达NIS基因的前列腺肿瘤细胞模型, 碘摄取增加了25%~30%, 为肿瘤的靶向性放射性核素治疗提供了有力的实验依据。
现有基因治疗载体均难以活体转导肿瘤的全部细胞, 但是I131等核素发射的β粒子射程可达数毫米, 使未转导的肿瘤细胞也得以被杀灭, 产生"旁观者效应"。因此, 联合应用NIS和放射性核素治疗肿瘤具有明显的优势[11]。我们的实验构建了携带hNIS基因的真核表达载体, 并转染HepG2肝癌细胞, 使肝癌细胞表达hNIS基因, 具备了聚集放射性元素碘的能力, 然后给与I131, 第四天时杀伤了约55%的转基因肝癌细胞。
基因转染技术和放射性碘结合是治疗低摄碘肿瘤的一种思路[12-15]。以上研究结果已充分显示了通过基因转染的方法诱导肿瘤细胞选择性摄取放射性碘的可能性与可行性, 使一些本身不能摄取放射性碘的恶性肿瘤可以主动摄取放射性碘, 从而使放射性碘浓集在肿瘤细胞内以达到杀伤肿瘤细胞的目的。
| [1] |
Levy O, Vieja A, Ginter CS, et al. N-linked glyeosylation of the thyroid Na+/Ⅰ- symporter[J]. J Biol Chem, 1998, 273: 22657-22663. |
| [2] |
Varyre L, Sabourin JC, Caillo B, et al. Immunoh is tochemical analysis of Na+/Ⅰ- symporter distribution in human extrathyroid tissues[J]. Eur J Endocrinol, 1999, 49: 517-523. |
| [3] |
Ajjan RA, Kamaruddin NA, Crisp M, et al. Regulation and tissued is tribution of the human sodium iod ide symporter gene[J]. Clin EndocrinolOxf, 1998, 49: 517-523. DOI:10.1046/j.1365-2265.1998.00570.x |
| [4] |
Spitzweg C, Joba W, Eisenmenger W, et al. Anolysis of human sodium iodide symportergene expression in extrathyroidal tissues and cloning of its complementary deoxyribonucleic acid from salivery gland, mammary gland, and gastricm ucosa[J]. JC lin Endocrinol Metab, 1998, 83: 1746-1751. DOI:10.1210/jcem.83.5.4839 |
| [5] |
Dai G, Levy O.Carrasco N. Cloning and charateriztion of the thyroid iodidetransporter[J]. Nature, 1996, 379: 458-460. DOI:10.1038/379458a0 |
| [6] |
SmankPA, Li uQ, FurmingerTL, et al. Cloningofthehuman sodiumiodide symporter[J]. Biochem Biophys Rescommun, 1996, 226: 339-345. DOI:10.1006/bbrc.1996.1358 |
| [7] |
Manell RB, Mendlell LZ, link CJ. Radioisotope concentrator gene therapy using the sodium/iodide symporter gene[J]. Cancer Res, 1999, 59: 661-668. |
| [8] |
Shimura H, Haraguchi K, Miyazaki A, et al. Iodide uptake and experimental131I therapy in transplanted undifferentiated thyroid cancer cells expressing the Na+/Ⅰ- symporter gene[J]. Endocrinology, 1997, 138(10): 4493-4496. DOI:10.1210/endo.138.10.5571 |
| [9] |
Cho JY, Xing S, Liu X, et al. Expression and activity of human Na+/Ⅰ- symporter in human gliomacells by adenovirus -mediated gene delivery[J]. Gene Ther, 2000, 7(9): 740-749. |
| [10] |
Spitzweg C, Zhang S, Elizabeth R, et al.Prostate-specific Antigen (PSA) Promoter-driven Androgen-inducible Expression of Sodium Iodide Symporter in Prostate Cancer Cell Lines.Cancer Res, 1999, 59: 2136-2141.
|
| [11] |
Rahmouni K, Sibug RM, De K, et al. Effects of brainmineralocorticoid receptor blockade on blood pressure and renal functions in DOCA-salthypertension[J]. Eur J Pharmacol, 2002, 436(3): 207-216. DOI:10.1016/S0014-2999(01)01586-2 |
| [12] |
贾悦, 唐伟, 刘超. 钠/碘转运体转基因介导放射性碘治疗非甲状腺恶性肿瘤的研究进展[J]. 国外医学, 肿瘤学分册, 2003, 30(3): 197-199. |
| [13] |
Nakarnoto Y, Saga T, Misaki T, et a1. Establishment and characterization of a breast cancer cell line expressing Na+/Ⅰ symporters for radioiodide eoncentrator gene therapy[J]. J NuclMed, 2000, 41: 1898-1904. |
| [14] |
Boland A, Ricard M, Opo〗 on P, et al. Adenovirusm ediated transfer of the thyroid sodium/iodide symporter gene into tumors for a targeted radiotherapy[J]. Cancer Res, 2000, 60: 3484-3492. |
| [15] |
Carrenard EP, Foglietti MJ, Beaudeux JL. Sodium/iodide symporter:physiopathological aspects and therapeutic perspectives[J]. Pathological Biogie, 2005, 53: 174-182. |



