2. 北华大学公共卫生学院;
3. 吉林市肿瘤医院
自噬是真核细胞蛋白降解的重要途径, 其作用主要是清除降解细胞内受损伤的细胞结构、衰老的细胞器及不再需要的生物大分子等, 同时也为细胞器的构建提供原料, 即细胞结构的再循环。细胞对这种合成与降解的精细调节, 对维持细胞自身稳态有重要意义。自噬是肿瘤细胞对外源性应激不同结果的反应, 许多证据表明自噬在肿瘤发生中同时具有促进和抑制作用。近年来, 肿瘤细胞自噬与凋亡二者之间关系的探讨已成为肿瘤治疗的热点之一。本实验室已对电离辐射诱导人乳腺癌细胞自噬与凋亡的关系进行了研究报道[1], 笔者主要探讨电离辐射联合自噬诱导剂、抑制剂对人宫颈癌Hela细胞凋亡率的影响, 其结论为提高宫颈癌放疗敏感性和增敏药物开发提供实验依据。
1 材料与方法 1.1 细胞株与材料宫颈癌Hela细胞由吉林大学卫生部放射生物学重点实验室保存。自噬抑制剂三甲基腺嘌呤(3-MA), Sigma公司产品, 批号M9281;自噬诱导剂(rapamycin), Sigma公司产品, 批号R8781;四甲基偶氮唑蓝(MTT)为华美生物工程公司产品。碘化丙锭(PI)购于Sigma公司, 批号P4170。
1.2 细胞培养及处理将Hela细胞置于含有10%胎牛血清、2%谷氨酰胺的RPMI 1640培养液中(pH 7.2~7.4), 在37 ℃、5%CO2培养箱中培养。细胞呈贴壁生长, 待其铺满瓶壁时以0.25%胰蛋白酶消化传代, 取对数生长期细胞进行实验。
1.3 照射条件及照射细胞国产X.S.S.205(FZ)型固定式X射线深部治疗机, 电压180 kV, 电流15 mA, 滤板0. 5 mm Cu+ 1.0 mm Al, 源靶距50 cm, 剂量率0.243 Gy·min-1。
1.4 MTT法测定吸光度(A)值取对数生长期的Hela细胞, 将细胞密度调整至每孔1×106个细胞, 接种于96孔培养板, 每种处理方式设置6个平行孔, 经0、2、4、6、8和10 GyX射线照射后继续培养, 于不同时间0、24、48和72h处理细胞, 同时设置阴性对照。测量前, 每孔加入MTT(5 g·L-1)20 μL, 继续培养4 h, 小心吸弃上清, 加入二甲基亚砜(150 μL/孔), 轻微震荡, 用全自动酶标仪检测各孔在490 nm处吸收光密度值(A490)。细胞生长抑制率(%)=(1-实验组平均A值/空白对照组平均A值)×100%。抑制率正值表示对细胞有杀伤作用, 负值表示对细胞有促增殖作用。
取对数生长期的Hela细胞, 将细胞密度调整至每孔5×105个细胞, 接种于96孔培养板, 6 GyX射线照射后再分别加入100 μL的3-MA(2 mmol·L-1)、rapamycin(1 mmol·L-1), 于不同时间0、24、48和72不得h测吸光度值。
1.5 流式细胞仪(FCM)检测细胞凋亡情况从制备好的细胞悬液经6 Gy照射后, 加入3-MA、rapamycin, 并在培养箱中培养24 h, 从中取1×106个细胞, 加PI(0.05 g·L-1, 含0.03% Triton X-100)200 μL, RNase(0.1 g·L-1)100 μL, 4 ℃避光染色30 min, 于FCM检测细胞凋亡率。Cell Quest软件收集1×104个细胞, ModFit软件分析细胞凋亡变化。
1.6 统计学方法细胞增殖抑制率及细胞凋亡率用x±s表示, 采用SPSS15.0软件进行统计学处理, 组间比较采用方差分析。
2 结果 2.1 不同剂量X射线照射后0~72 h Hela细胞增殖抑制率随着照射剂量的增加, 时间的延长, 应用MTT法检测的Hela细胞吸收光密度值逐渐减小。与0 Gy组比较, 随着照射剂量的增加(2、4、6、8和10 Gy), 各处理组细胞增殖抑制率差异有统计学意义(P<0.05或P<0.01), 即促进了肿瘤细胞凋亡。同时, 随着照射后时间的延长, 细胞凋亡增多; 照射后48和72 h, 其吸收光密度值明显低于0h组(P<0.05或P<0.01)。表 1所示, 随着照射后时间的延长, MCF-7细胞增殖抑制率明显增加(P<0.05或P<0.01), 说明电离辐射能够抑制其细胞增殖, 促进Hela细胞凋亡。
|
|
表 1 不同剂量X射线照射后0~72 h人宫颈癌Hela细胞增殖抑制率(x±s, %; n=6) |
表 2所示, 6 Gy+rapamycin、6 Gy+3-MA和6 Gy各处理组随着作用时间延长, 与对照组相比较, Hela细胞吸光度值明显下降(P<0.05), 细胞增殖抑制明显上升(P<0.05)。与0h比较, 照射后24、48和72h, 其细胞增殖抑制率差异有统计学意义(P<0.05或P<0.01)。然而, 6 Gy+rapamycin组对细胞凋亡的影响低于6 Gy与6 Gy+3-MA对其细胞凋亡的影响, 且二者之间存在统计学差异(P<0.05或P<0.01), 说明电离辐射联合自噬抑制剂能促进肿瘤细胞凋亡, 而电离辐射联合自噬诱导剂能抑制肿瘤细胞凋亡, 在Hela细胞中自噬能够拮抗凋亡。
|
|
表 2 6 GyX射线照射联合自噬诱导剂或抑制剂对Hela细胞增殖抑制率影响(x±s, %; n=6) |
0 Gy组细胞凋亡百分率为11.2±1.71;与0 Gy组比较, 用3-MA处理Hela细胞, 其凋亡百分率为12.47±1.57(P<0.01);用rapamycin处理细胞, 其凋亡百分率为9.98±1.67(P<0.05)。单纯6 Gy照射, 其凋亡百分率为13.4±2.05, 与单纯6 Gy组比较, 6 Gy+3-MA处理细胞, 其凋亡百分率分别为17.3±2.67(P<0.01);6 Gy+rapamycin处理组其凋亡百分率为12.6±1.97(P<0.05);6 Gy照射联合自噬抑制剂或诱导剂, 其凋亡百分率分别高于不经照射单独使用抑制剂或诱导剂处理组(P<0.05或P<0.01, 图 1)。
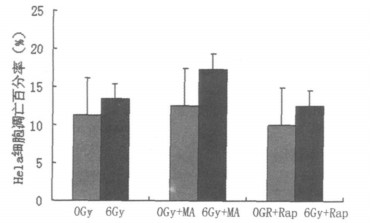
|
图 1 不同处理方式Hela细胞凋亡百分率 |
自噬与包括肿瘤在内的多种人类疾病有关, 既能够保护细胞, 也能造成细胞损伤。对于某些细胞, 在自噬与凋亡的关系中, 自噬通常先于凋亡, 进而启动凋亡; 对于凋亡而言, 自噬是不可缺少的[2]。本实验结果表明, 使用自噬抑制剂(3-MA)可促进Hela细胞凋亡; 而使用自噬诱导剂(rapamycin), 则抑制Hela细胞凋亡。提示, 电离辐射诱导Hela细胞自噬和凋亡的关系中, 自噬能够拮抗凋亡。另据文献报道[3], 自噬可能通过清除破损线粒体延迟凋亡和对抗凋亡, 自噬的抑制可能会提高细胞对凋亡信号敏感性。自噬体形成可能与TNF-α依赖的凋亡有关[4]。TNF-α可诱导白血病细胞系CCRF-CEM和长春碱耐受的CEM/VLB100发生自噬及凋亡, 且自噬早于核黄素片段出现, 3-MA可完全抑制DNA片段化和胞浆降解, 而天冬酰胺(溶酶体和自噬体融合抑制剂)不能阻断TNF-α诱导的凋亡。可见, 早期自噬体形成虽不一定导致TNF-α诱导的凋亡, 但却是凋亡必需的。已有文献证实[5], 细胞中抑制自噬活性可以将死亡信号由自噬型细胞死亡转到凋亡型细胞死亡。本实验结果与此报道一致。
本实验中使用自噬诱导剂(rapamycin)可抑制Hela细胞凋亡。提示, 自噬性细胞死亡和凋亡虽然是两条不同的细胞死亡途径, 但二者并不是相互孤立的, 重叠部分在特定条件下可以转化。目前, 两型细胞死亡之间的具体转化机制还不清楚。有文献报道[6], 线粒体可能涉及自噬和凋亡两种作用的整合。各种因素(如氧化、缺血/再灌注、TNF-α、FasL、钙超载、毒性化合物)刺激下, 线粒体渗透性转运通道(MTP)开放, 线粒体肿胀, 释放细胞色素c等凋亡因子促进细胞凋亡[7]。
自噬作为保护肿瘤细胞避免受到低营养、电离辐射和治疗损伤所诱导的应激的一种保护机制[8]。在肿瘤进展过程中, 由于血供减少, 肿瘤细胞特别是肿瘤内部细胞在乏氧和营养受限的状况下生存。乏氧和营养缺乏均能刺激自噬启动, 通过自噬对胞内物质的降解和循环利用而改变新陈代谢。同时, 自噬对线粒体的分隔可防止促凋亡因子如细胞色素和凋亡因子(AIF)的扩散。自噬的这种作用能够帮助肿瘤细胞逃逸凋亡[9]。这一理论与本实验中诱导自噬抑制了Hela细胞凋亡结论相一致。在Hela细胞中, 电离辐射诱导自噬与凋亡之间存在交叉机制, 其中许多激酶, 如PI3K、Beclin1和PTEN等, 其具体作用机制还有待进一步研究。
| [1] |
齐亚莉, 张震宇, 王洪艳, 等. 电离辐射诱导人乳腺癌细胞自噬与凋亡的关系[J]. 吉林大学学报:医学版, 2009, 35(6): 1007-1010. |
| [2] |
Saeki CJ, Stellrecht CM, Nimmanapalli R, et al. Targeting MET transcription as a therapeutic strategy in multiple myeloma[J]. Cancer Chemother Pharmacol, 2009, 63(4): 587-597. DOI:10.1007/s00280-008-0770-2 |
| [3] |
Esposti, Davide Degli, Domart, et al. Autophagy is in duced by ischemic preconditioning in human livers formerly treated by chemotherapy to lim it necrosis[J]. Autophagy, 2010, 6(1): 172-174. DOI:10.4161/auto.6.1.10699 |
| [4] |
Yousefi, Shida, Simon, et al. Autophagy in cancer and chemotherapy[J]. Results Probl Cell Differ, 2009, 49(3): 183-190. |
| [5] |
Besson A, Dowdy SF, Roberts JM. CDK inhibitors:cell cycle regulators and beyond[J]. Dev Cell, 2008, 14(7): 159-169. |
| [6] |
Levine1 B, Kroemer G. Autophagy in the pathogenes is of disease[J]. Cell, 2008, 132(1): 27-42. DOI:10.1016/j.cell.2007.12.018 |
| [7] |
魏清. 自噬的诱导机制及其在肿瘤治疗中的作用[J]. 国际病理科学与临床杂志, 2008, 28(1): 45-48. |
| [8] |
Jaeger PA, Wyss-Coray T. All-you-can-eat:autophagy in neurodegeneration and neuroprotection[J]. MolNeurodegener, 2009, 4(1): 16. |
| [9] |
Brian J.Altman, Jessica A.Wofford, Yuxing Zhao, et al. Autophagy provides nutrients but can lead to chop-dependent induction of bim to sensitize growth factor-deprived cells to apoptosis[J]. Mol Biol Cell, 2009, 20(4): 1180-1191. DOI:10.1091/mbc.e08-08-0829 |






