2. 华北煤炭医学院药理教研室;
3. 河北省临城县人民医院放射科
胃肠道间质瘤(gastrointestinal stromal tumor, GIST)是消化道非上皮性肿瘤, 来源于胃肠道间叶组织中具有多项分化潜能细胞的肿瘤, 从食管到肛门的消化道均可发生。Mazur和Clark在[1] 1983年首次提出了胃肠道间质瘤的概念, 但一直没有明确定义。近年来, 随着免疫组织化学、电镜和分子生物学等技术的应用, 认为它是一组具有非定向性分化特征的间质肿瘤。笔者汇集了医院从2004年1月到2009年8月20例经手术病理证实的GIST, 探讨MSCT对其诊断价值。
1 资料与方法 1.1 临床资料本组20例, 男12例, 女8例, 年龄29~80岁, 平均年龄56.5岁。20例均有完整的CT资料, 8例有胃肠道造影及电子内镜检查资料, 全部病例均经手术病理证实。病程4d ~4a。主要临床症状:腹部不适4例, 腹部肿块3例, 腹痛腹泻便血9例, 发热1例, 体检发现3例。
1.2 检查方法20例均使用Siemens Somatom Sensartion 16层CT平扫和增强扫描。患者空腹6~8h, 扫描前15min口服2%泛影葡胺500ml充盈胃肠道, 前10min肌注654 2~20mg。拟下腹部大肠病变时, 经肛门注入气体。常规取仰卧位, 根据病情确定扫描部位。层厚5mm, 间隔5mm, 扫描参数120kV, 150mAs。先平扫后增强, 增强扫描时, 用高压注射器经肘前静脉注射优维显100ml (300mgI/ml), 速率为3.0~4.0ml/s, 动脉期选择30s开始扫描, 静脉期选择60s扫描。
2 结果 2.1 GIST的性质与分布本组20例, 良性9例, 恶性10例, 潜在恶性1例。肿瘤位于胃部7例(图 1~2), 良性4例, 恶性2例, 潜在恶性1例; 十二指肠3例(图 3), 良性2例, 恶性1例; 空肠(图 4) 4例, 良性1例, 恶性3例; 回肠3例(图 5), 良性2例, 恶性1例; 肠系膜1例(图 6), 恶性; 直肠2例(图 7), 全为恶性。
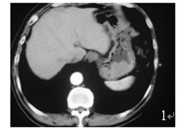
|
图 1 示胃体部大弯侧软组织肿物向腔内突出 |
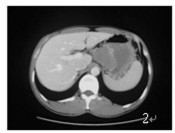
|
图 2 示胃底小弯侧向腔外生长的软组织肿物, 位于肝左叶后外侧段之间 |
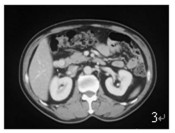
|
图 3 示十二指肠降部外侧壁可见哑铃状向腔内外同时生长的肿物 |
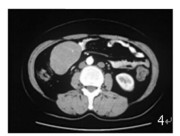
|
图 4 示右下腹部可见椭圆形肿物(7.6 ×5.2cm), 边界清楚 |
|
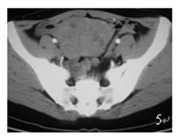
图 5 示盆腔内子宫前方可见密度不均的较大软组织肿物(8.0 ×5.2cm), 内有坏死 |
|
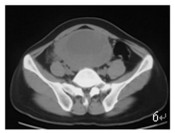
图 6 示盆腔上方大囊实性肿物(10 ×8cm) |
|
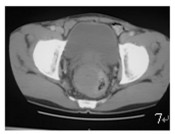
图 7 示直肠右侧壁肿物, 致直肠腔狭窄 |
良性的GIST, 呈圆形或椭圆形(腔内外同时生长的呈哑铃形), 最小截面1.5 cm×2cm, 最大截面5.2cm ×7.0cm, 平均最大直径4.4cm; 恶性的GIST呈不规则形, 分叶状生长, 胃肠壁多有增厚, 最厚达4.7cm, 最小截面3.7 cm× 5.8cm, 最大截面10 cm×18cm, 平均最小直径6.0cm, 平均最大直径为9.3cm; 潜在恶性的GIST呈扁盘状, 界面为2.4 cm× 3.7cm。
2.2.2 平扫与增强扫描的特点GIST平扫均匀等密度的9例, 其中良性的6例, 恶性3例, CT值35~50Hu, 平均40 Hu, 增强后CT值49~117Hu, 平均81 Hu; GIST平扫密度不均的11例, 其中良性的3例, 恶性7例, 潜在恶性1例, 平扫CT值26~ 47Hu, 由周边向中央CT值逐渐变小, 中央有坏死和囊变, 有4例可见钙化(手术证实其中2例破裂出血), 1例明显囊实性成分组成(图 6), 增强后亦呈不均匀强化, CT值为31~92Hu, 周围实性组织显著强化, 坏死囊变区无强化。20病例中17例静脉期强化高于动脉期。
2.2.3 肿瘤的边界与周围组织结构的关系良性和潜在恶性的GIST大部分边界清楚, 对周围组织器官无影响, 仅3例压迫临近器官, 其中胃底小弯侧的GIST压迫压迫肝左叶后外侧段, 十二指肠降部和水平部的GIST压迫胰头向内和后移位, 未见到侵犯临近器官和组织; 恶性GIST肿块体积大, 外形不规则, 5例边界尚清楚, 2例对周围器官有外压改变, 1例周围脂肪间隙模糊, 1例肠系膜密度增高、肠系膜间隙及结肠脾区可见数个大小不等淋巴结, 最大的短径1.3cm, 1例肠壁显著增厚、肠腔显著狭窄致出现小肠气液平肠梗阻表现, 大网膜密度增高。无论良性恶性GIST局部壁都有强化。
3 讨论GIST是一组独立的起源于胃肠道原始间叶组织, 具有多向分化潜能, 表达CD 117, 富于细胞的梭形、上皮样、偶或多形性的间叶性肿瘤[2], 多见于中老年, 40岁前少见, 多发生于胃(60%~70%), 其次为小肠(20%~30%), 结直肠(10%), 食道(5%)[3], 偶尔发生于网膜、肠系膜和腹膜后等。Rosai和Ackerman[4]通过免疫组化、超微结构将GIST分为4个类型:平滑肌分化型、神经分化型、平滑肌和神经双向分化型和未分化型。
3.1 GIST临床病理特点该病临床少见, 常见于中老年人, 本组20例中仅1例29岁, 40岁以下2例, 50岁以下2例, 其余全大于50岁。临床表现无特异性, 常见症状腹部不适、腹部肿块、腹痛、腹泻、便血、发热等。临床症状与肿瘤大小, 发生部位及良恶性有关。它可发生于胃肠道任何部位。良恶性GIST均以膨胀性生长为主, 周围浸润相对较少, 本组12例对周围组织器官无明显影响, 仅5例对器官有外压改变, 3例周围脂肪间隙模糊(其中1例有淋巴结转移)。良性GIST瘤体较小, 直径多小于5cm, 密度多均匀; 恶性GIST瘤体大, 直径大于5.5cm, 密度多不均匀, 分叶状生长。良恶性GIST血供丰富, 强化明显。瘤体较大时, 如果血供不能满足其需求, 瘤体内就发生坏死囊变出血。瘤体内可发生钙化。
3.2 GIST的CT表现GIST多表现为软组织肿块, 根据瘤体与胃肠壁的关系分为4型:①粘膜下型:CT表现为向腔内生长的软组织肿块, 基底与胃肠壁相连, 多呈椭圆形或圆形, 边界清楚, 体积较小可有浅切迹, 大多密度均匀, 增强均匀强化, 良性居多; ②浆膜下型:肿瘤向腔外生长, CT表现为向腔外生长的软组织肿块, 界多较清楚, 肿块与胃肠道壁关系密切, 肿块大多密度均匀, 均匀强化; ③肌壁间型:瘤体向腔内外同时生长, 典型的呈哑铃状生长, 对周围组织器官有不同程度的推挤、压迫现象, 病灶一般范围较大, 相应壁增厚, 密度不均, 可有坏死, 强化不均匀; ④胃肠道外型; 病变起源于胃肠道以外其他部位如肠系膜, 多表现为孤立的边界清楚的圆形或椭圆形软组织肿块, 密度均匀或囊实成分共存, 一般瘤体较大, 强化明显。GIST在CT上如果表现为密度均匀, 边界清楚, 瘤体小于5cm, 均匀强化多为良性, 如果表现为瘤体大于5.5cm, 呈不规则样生长, 深分叶, 密度不均, 有囊变坏死出血钙化, 且不均匀强化, 多为恶性, 如果周围组织器官受累更加肯定诊断[5]。
3.3 GIST的鉴别诊断 3.3.1 平滑肌原性肿瘤和神经性肿瘤(特别是视神经鞘瘤)二者均表现为均匀的软组织肿块, 大多边界清楚, 此类肿瘤难以与良性GIST鉴别, 从发生机率来看, GIST较多发, 所以首先考虑GIST的诊断。确诊需要病理学及免疫组织化学检查。GIST的特征是梭形细胞肿瘤, 免疫组化染色CD117阳性, Actin阳性等也助于诊断[6]。
3.3.2 淋巴瘤淋巴瘤常为多个部位和器官同时发生。胃淋巴瘤分为两型, 浸润型表现为多发息肉样肿块, 胃腔内多发不规则充盈缺损; 溃疡型可见不规则龛影, 同时伴有胃壁增厚。小肠淋巴瘤多处侵犯, 特征性表现是"动脉瘤样扩张"[7], 易于GIST鉴别。
3.3.3 胃肠道癌此类肿瘤起于粘膜层, 多表现为粘膜破坏中断, 腔内不规则充盈缺损, 大而形态不规整的龛影, 周围有较宽的水肿带, 临近壁增厚僵硬。多突破浆膜局部有淋巴转移。GIST粘膜多无破坏, 边界多清楚, 少见溃疡形成, 少有淋巴转移。
3.4 GIST的检查方法的比较一般来讲, 由于钡餐造影简单易行, 患者痛苦较小, 常作为GIST的首选检查方法。钡餐造影能够从整体上观察病变的部位、大小、形态和范围, 适用于腔内型和腔外型病变。腔内突出者表现为充盈缺损, 临近粘膜无破坏, 壁柔软; 腔外型引起临近器官受压移位及变形, 但观察肿块与胃肠道关系受到一定限制, 故此检查不能准确估计肿块大小和形态, 而文献报道GIST多倾向向腔外生长[8], 所以钡餐造影检查有局限性。
内镜检查可以直接观察胃肠道病变, 如粘膜表面是否完整, 是否有溃疡, 是否有腔内生长的肿物, 并可取组织病理检查。但GIST大多数病例粘膜完整或仅有小溃疡, 内镜容易漏诊和误诊, 尤其是向腔外生长的肿物内镜无法显示。内镜检查还有一个缺点是给患者造成一定的痛苦。
超声检查可以观察到肿瘤, 并可测量肿瘤大小, 但对肿瘤外形的显示及与周围组织关系不及CT, 对肿瘤的鉴别诊断有限。
MSCT具有密度分辨率高, 组织对比好的优势, 可清晰显示GIST的部位、密度、大小、形态、边缘、生长方式, 可显示肿瘤内部的囊变、坏死、出血和钙化等, 还可先显示其与胃肠道壁的关系及肿瘤与邻近组织器官的关系及转移情况。增强扫描后观察肿瘤血供情况, 为肿瘤定性提供更多的信息, 明确肿瘤与血管的关系, 为手术提供依据。对腔外生长得肿瘤, MSCT比钡餐造影和内镜有独特的优势。
总之, 笔者认为MSCT是目前GIST检查最有效的手段, 有较高的诊断价值①可清楚显示肿块大小、形态、范围、边缘轮廓②可显示肿瘤内部情况, 是否囊变坏死、出血、钙化等改变③可显示肿瘤与临近组织器官关系④与胃肠道造影、内窥镜等技术相结合, 提高GIST的检出率, 并在一定程度上指导临床治疗及术式的选择。
| [1] |
Mazur M, Clark H B. Gastric sctromal tumors:areappraisal[J]. Am J Surgpathol, 1983, 7(6): 507-519. |
| [2] |
朱雄增, 侯英勇. 对胃肠道间质瘤的再认识[J]. 中华病理学杂志, 2004, 33(1): 3. DOI:10.3760/j.issn:0529-5807.2004.01.002 |
| [3] |
Miettinen M, Monihan J, Sarlomo-Rikala, et al. Gastronintestinal stromal tumors/smooth muscle tumors (GISTs) primary in the omentum and mesentery; linicopathologic and immuno - histoche mical study of 26 cases[J]. Am j Surg pathol, 1999, 23(9): 1109. DOI:10.1097/00000478-199909000-00015 |
| [4] |
Rosai J, Ackerman LV. Ackerman ' s surgical pathology[M]. St. louis: Mosby, 1996: 645-647.
|
| [5] |
唐光健, 朱月香. 胃肠道间质瘤的CT诊断[J]. 中华放射学杂志, 2006, 40: 843-845. DOI:10.3760/j.issn:1005-1201.2006.08.016 |
| [6] |
Hou YY, wang J, Zhu XZ, et al. Aclinicopathologic and immunohis-tochemical study on 76 cases of gastrointestinal stromal tumors[J]. Chin J Pathol, 2002, 31(1): 20-25. |
| [7] |
周建春, 郭亮, 沈海林, 等. 胃肠道间质肿瘤的影像表现[J]. 中华放射学杂志, 2003, 37(2): 131-134. DOI:10.3760/j.issn:1005-1201.2003.02.009 |
| [8] |
Migon F, Julie C, Izzillo R, et al. Imaging features of gastric stromal tumors:radiologic-pathologic correlation, report of 4 cases[J]. Radiol, 2000, 81(8): 874. |


