胃肠道是非霍奇金氏淋巴瘤(Non-Hodgkin ' s lymphoma, NHL)累及淋巴结以外的常见部位, 由于常规X射线检查及B超、内镜对胃肠粘膜变下病病变具有一定的局限性, 加上胃肠道淋巴瘤临床症状缺乏特征性, 早期诊断较为困难。笔者采用16层螺旋CT(multi -slice spiral CT, MSCT)及1.5TMRI诊断胃肠道淋巴瘤35例, 报告如下。
1 材料和方法 1.1 一般资料收集2004年1月~2008年12月在我院手术或活检病理证实的胃肠道淋巴瘤35例, 其中男25例, 女10例; 年龄19~81岁, 平均55.3岁。临床症状主要为腹痛、腹胀、便中带血、腹部包块、消瘦等。其中原发性胃肠道淋巴瘤30例, 继发性淋巴瘤5例。
1.2 扫描前准备检查前三日禁做胃肠道钡剂造影检查, 检查前10~12h口服复方聚乙二醇电解质散(散剂, 59.56g) 2盒+温开水2 000ml口服。检查当日禁食。扫描前15min内口服胃肠道充盈混合溶液1 000ml, 配比方案为5%葡萄糖注射液500ml +20%甘露醇注射液250ml +饮用水250ml。检查目的以小肠为主者, 再口服饮用水1 000ml。若以结肠为重点观察者, 则再经肛门注入1 000~2 000ml左右温生理盐水(根据病人耐受而定), 扫描前肌肉注射东莨菪碱注射液20mg (有禁忌症者除外)。
1.3 MSCT检查方法美国GE公司生产的LightSpeed 16排多层螺旋CT。扫描参数:管电压120 kV, 管电流280 mAs, 螺距1.375:1, 层厚10mm所有病人均采用双期增强扫描, 肘静脉注射, 速率3.0ml/s, 造影剂300mgI/L碘帕醇或碘海醇100ml; 扫描范围自膈顶到耻骨联合下缘。增强扫描图像在adw4.1工作站进行图像后处理, 重建层厚1.25mm, 重建间隔0.8mm。
1.4 MRI检查方法采用GE 1.5 T HD或HDE磁共振成像仪, 8通道相控阵腹部体线圈, 常规行稳态采集快速成像(FI - ESTA)不加脂肪抑制行冠状位、轴位T 1WIFSE或FSPGR、T 2WIFSE序列扫描、FIESTA +脂肪抑制轴位、冠状位。扫描范围自膈顶到耻骨联合下缘, 病变部位加DWI EPI序列扫描; 选用三维容积内插快速梯度回波序列(LAVA)增强扫描, 造影剂为钆喷替酸葡甲胺(Gd-DTPA, 0.1mmol/kg)行轴位、冠状或矢状位扫描。用adw 4.3工作站重建图像。
2 结果 2.1 病理诊断本组35例病理均为NHL, 免疫组化弥漫大B细胞性24例, 小B细胞性11例。MSCT检查28例, MRI检查7例, 其中2例CT、MRI双重检查。
2.2 病变部位35例患者中, 26例为单发, 9例为多发, 共发现病灶46处, 其中发生于胃18例(其中胃底1例, 胃体9例, 胃窦8例), 空肠病灶2处, 回肠者16处病灶(4个病灶回肠末端累及回盲部), 结肠病灶10处。
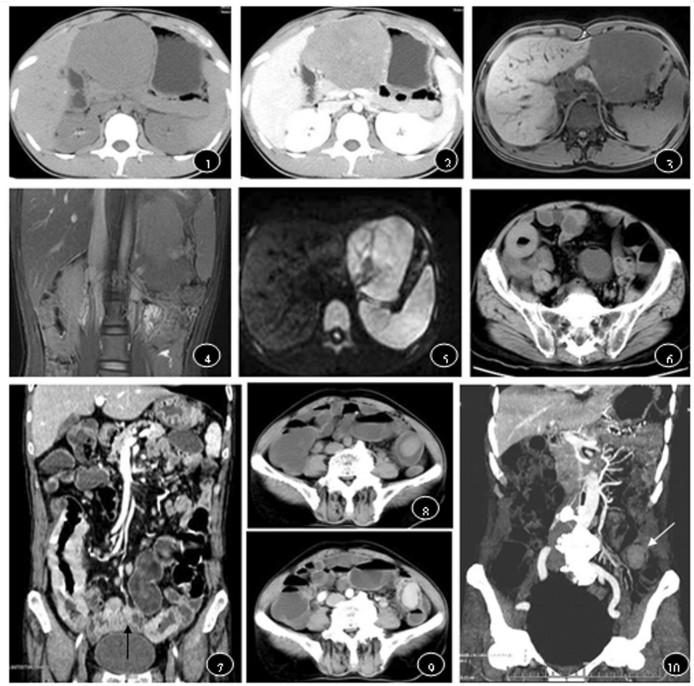
2.3 MSCT表现18例胃淋巴瘤中8例表现为胃壁弥漫浸润增厚, 壁厚度约0.6~3.5cm, 10例表现为胃壁局限性结节状、团块状增厚(图 1~2), 最大直径2.6~10.2cm, 平扫CT值约30.3~44.7HU, 增强后轻中度均匀强化, CT值约39.5~87.8 HU, 大多数密度均匀。17例肠道淋巴瘤中7例表现为肠壁呈弥漫性或偏心性增厚, 肠壁边缘欠光整, 部分肠腔轻度狭窄, 受累肠管长度在3.5cm~12.6cm间, 病变肠管厚度在0.8cm~ 2.3cm间, 4例表现为受累肠管壁明显增厚, 但受累肠腔不出现狭窄, 反而有扩张, 呈"动脉瘤样扩张"的特征性改变(图 6~7), 6例表现为肠腔内较大息肉样软组织肿块(图 8~10), 边缘光滑, 可有分叶, 平扫CT值约32.8~42.2HU, 增强后均匀强化, 其中轻度强化(CT值增加10~20HU)4例, 中度强化(CT值增加21~40HU)7例, 1例高度持续均匀强化, 门脉期CT值约102.3HU, CT值增加达70HU, 腔内见小气液平面; 4例伴邻近肠系膜或腹膜后淋巴结肿大, 其中2例表现为"夹心面包征"。3例患者小肠多节段分布, 2例患者结肠、回肠多节段分布; 4例回肠末端累及回盲部。
|
图 1~5为胃NHL, 图 1 CT轴位平扫显示胃体部粘膜下团块样增厚, 密度均匀。图 2 CT增强后显示肿瘤轻度均匀强化, 粘膜清晰如常, 浆膜层光滑。图 3~5分别为MRI横断位T 1 WI、冠状位T 2 WI、横断位DWI, 肿瘤表现为T 1WI低信号, T 2WI稍高信号, DWI高信号。图 6~7小肠动脉瘤样扩展型淋巴瘤, 图 6 CT平扫显示回肠远端肠壁明显增厚, 最厚处约1.7 cm, CT值41.4HU。图 7增强冠状位MPR重建, 病灶中度强化, 同时显示远端回肠多节段肠壁增厚(黑箭), 并见肠系膜多发淋巴结显示。图 8~10乙状结肠NHL, 图 8CT平扫显示肿块向肠腔内息肉样突入, 密度均匀, 边缘光整。图 9 CT增强肿块均匀强化图 10 MIP冠状位重建, 显示肿块更加直观(白箭)。 |
本组7例行MRI检查, 胃2例, 小肠1例, 小肠结肠多节段病灶2例, 结肠2例。2例胃淋巴瘤表现为胃壁粘膜下团块状增厚, T 1WI与肌肉信号相比呈略低信号, T 2WI呈稍高信号, DWI呈高信号, 信号基本均匀(图 3~5), 注射造影剂后呈轻中度强化; 5例肠道淋巴瘤表现为肠壁结节状团块状增厚, T 1WI与肌肉信号相比呈等低或低信号, T 2WI呈稍高信号, DWI呈高信号, 信号均匀, 增强后轻中度强化, 2例合并肠系膜及后腹膜淋巴结肿大。
3 讨论胃肠道是结外淋巴瘤最常见的发病部位, 其中胃最多见, 其次为小肠, 结、直肠, 食管最为罕见, 多见于成年人, 男性多于女性。胃肠道淋巴瘤起自胃肠道黏膜固有层和黏膜下层的淋巴组织, 其中绝大多数为NHL, HD极为罕见, 主要起源于B淋巴细胞[1], 肠道的淋巴瘤亦可起源于T淋巴细胞。本组资料全为NHL-B淋巴细胞型。由于常规内镜、超声及胃肠造影对胃肠道粘膜下病变检查有明显的限度, MSCT及MRI在胃肠道淋巴瘤检查中的地位显得更加突出。
3.1 肠道NHL的MSCT及MRI检查方法MSCT胃肠道扫描不仅可以发现病变, 同时可以观察病变胃肠道壁受累的程度和范围、淋巴结转移情况以及肿瘤的分期等。检查前良好的肠道清洁准备是获取优质图像的前提, 本组病例采取复方聚乙二醇电解质散导泻, 肠道清洁效果良好, 能满足检查要求。低张药物的使用, 能有效抑制肠蠕动所产生的伪影。本组病例采用口服甘露醇混合溶液充盈胃腔及小肠, 肠腔充分扩张, 同时向结肠内注入1 200~2 000 ml生理盐水做对比剂, 利于病变的显示。MSCT容积扫描获得的数据通过后处理获得的图像能进行MPR及MIP等重建, 能清楚显示胃肠管整体形态、胃肠壁增厚程度及其范围、肠系膜及后腹膜的淋巴结改变, CTA能清楚显示肿瘤与血管的关系[2-4]; 同时腹部大范围扫描能显示肝胆脾肾等实质性脏器情况, 这些对肿瘤的定位、定性及对判断有无周围脏器转移都具有很大的优势。MRI检查直接进行多方位多参数扫描方法, 能获得更多更直接的病变信息, 目前, 随着3DLAVA技术的成熟应用, 使得以胃肠道为目的的MRI腹部大范围扫描也能获得清晰的高质量图像, 其重建MIP及MRA也能更好地观察胃肠壁增厚程度及其范围、周围淋巴结改变及肿瘤的与血管的关系。且MRI对于胃肠道粘膜结构显示较CT清晰, 且对淋巴瘤骨骼早期受累敏感, MRI检查在胃肠道淋巴瘤鉴别诊断中优于CT。
3.2 胃肠道NHL的MSCT及MRI表现特征胃肠道NHL为胃肠道单发或多发病变, 其MSCT及MRI表现形态特征大致相仿。胃NHL以胃体胃窦部多见, 小肠NHL则以回肠末端及回盲部多见[5], 本组NHL中发生于胃体胃窦者17例(17/18), 发生于回肠者16例(16/18), 与文献一致。CT平扫表现为均匀稍低密度, MRI表现为T 1WI等低或低信号, T 2 WI为稍高信号, DWI为高信号, 增强后轻中度强化。常以胃肠壁粘膜下浸润性或不规则形偏心性增厚、息肉样或团块状黏膜下肿块为特征, 小肠淋巴瘤当病变浸润肠壁并破坏肠壁内神经丛时, 出现另一特征性改变, 即肠管呈"动脉瘤样扩张", 可伴有病灶周围、腹腔及腹膜后淋巴瘤肿大, 典型者出现"夹心面包征"。分析本组资料并结合相关文献[6, 7], 以下CT、MRI征象有助于胃肠道恶性淋巴瘤的的诊断:①胃肠壁弥漫性或偏心性增厚, 或腔内粘膜下肿块; ②病灶密度信号均匀, 少有液化坏死; ③增强后病灶轻中度均质强化, 粘膜线大部分无中断; ④病变可多节段累及胃肠道, 病变胃肠壁保持一定的柔软度; ⑤小肠肠管出现动脉瘤样扩张为淋巴瘤特征性改变。
3.3 胃肠道NHL的的鉴别诊断胃原发性淋巴瘤的影像学表现易与胃癌(尤其是浸润型胃癌)、胃肠道间质瘤(GIST)混淆。当胃癌表现为弥漫性胃壁增厚时, 通常胃壁僵硬, 胃腔狭窄; 而淋巴瘤的胃壁柔软, 即使弥漫性胃壁增厚, 胃腔亦很少狭窄。胃癌更倾向于向周围组织器官转移侵犯, 此外, 淋巴瘤引起的胃周淋巴结增大通常比在胃癌多见, 尤其是引起肾门以下淋巴结增大更较后者多见。胃部GIST是常向腔外生长的肿块, 平扫和增强密度尚均匀, 可有中心坏死、溃疡形成或者钙化, 但GIST一般强化较胃淋巴瘤明显。
小肠淋巴瘤以单发肠壁增厚者需与小肠腺癌鉴别, 小肠腺癌好发于近端小肠, 肠管形态僵硬, 管腔易呈向心性狭窄, 边缘多不规则, 浆膜层多模糊, 向周围呈浸润性生长。多发节段性分布的小肠淋巴瘤需与小肠Crohn病鉴别, 小肠Crohn病常引起肠壁全层增厚, 其增厚较均匀、规则, 增厚的程度一般较轻, 为多节段病变, 范围较广泛, 病变呈跳跃式分布, 其活动期肠壁明显强化, 引起的肠系膜淋巴结增生体积一般较小, 形态也较规则[8]。
结肠淋巴瘤主要与结肠癌鉴别, 结肠癌CT、MRI表现主要为肠壁增厚呈环形、半环形增厚或肠腔内偏心性分叶状肿块, 肠腔狭窄明显, 粘膜破坏中断, 肿瘤穿透肠壁时浆膜层显得模糊毛糙, 肠周脂肪线消失, 增强扫描肠壁轻度均匀或不均匀强化, 易侵犯周围脏器, 可伴腹腔及腹膜后淋巴结肿大, 早期结肠癌与息肉样肿块型淋巴瘤鉴别较困难, 需病理明确诊断。
| [1] |
武忠弼, 杨光华. 中华外科病理学[M]. 北京: 人民卫生出版社, 2002: 702.
|
| [2] |
Kin JH, Eun HW, Goo DE, et al. Imaging of various gastric lesions with 2D MPR and CT gastrography performed with multi -detector CT[J]. Radiographics, 2006, 26(4): 1 101-1 116. DOI:10.1148/rg.264055089 |
| [3] |
Romano S, De Lutio E, Rollandi GA, et al. Multi-detector computed tomography enteroclysis(MDCT-E) with neutralenteral and Ⅳ contrast enhancement in tumor detection[J]. Eur Radiol, 2005, 15(6): 1 178-1 183. DOI:10.1007/s00330-005-2673-5 |
| [4] |
纪建松, 卢陈英, 赵中伟. 螺旋CT及重建技术对小肠肿瘤的诊断价值[J]. 实用放射学杂志, 2008, 24(1): 52-61. DOI:10.3969/j.issn.1002-1671.2008.01.015 |
| [5] |
Ibrahim EM, Ezzat AA, El-Weshi AN, et al. Primary intestinal diffuse large B-cell non-Hodgkin ' s lymphoma:linical features, management, and prognosis of 66 patients[J]. Ann Oncol, 2001, 12(1): 53-58. DOI:10.1023/A:1008389001990 |
| [6] |
章士正. 小肠影像诊断学[M]. 北京: 人民军医出版社, 2006: 182-189.
|
| [7] |
靳勇, 张华, 吴达明, 等. 胃肠道淋巴瘤的多层螺旋CT影像学分析[J]. 临床放射学杂志, 2006, 25(10): 928-931. DOI:10.3969/j.issn.1001-9324.2006.10.009 |
| [8] |
Boudiaf M, Jaff A, Soyer P, et al. Small-bowel diseases:prospective evaluation of multi -detector row helical CT enteroclysis in 107 consecutive patients[J]. Radiology, 2004, 233(2): 338-344. DOI:10.1148/radiol.2332030308 |


