2. 中国原子能科学研究院, 北京 102413;
3. 苏州大学放射医学与公共卫生学院, 江苏 苏州 215123
电离辐射可以在哺乳动物细胞中诱发直接的生物效应, 包括基因突变、染色体畸变、细胞恶性转化和死亡。细胞凋亡是细胞死亡的一种重要的生物学模式, 它是细胞对非急性致死的有害刺激协调适应反应的体现, 是一个利它的细胞自杀过程[1, 2]。电离辐射可以引起多种类型的DNA损伤及修复, DNA损伤若不能修复, 就会诱发细胞凋亡, 这从根本上减少了"不稳定"细胞恶性转化的趋势, 从而保证基因组的遗传稳定性[2, 3]。本研究利用流式细胞术对受照人正常肝细胞7702进行凋亡检测, 通过对不同剂量组人正常肝细胞7702凋亡率的统计分析, 为辐射诱导细胞凋亡的机制研究提供理论依据。
1 材料与方法 1.1 细胞株人正常肝细胞株7702购自中科院上海细胞所。
1.2 主要试剂及仪器RPMI 1640培养基(GIBCO公司, 美国), 小牛血清(杭州四季青生物材料研究所), AnnexinV-FITC细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司), 流式细胞仪(BECK MANCO ULTER cytomics FC500 flowcytometer)。
1.3 细胞培养与照射在含20 %小牛血清、100 U/ml青霉素和100 μ g/ml链霉素的RP MI1640培养基中, 于37℃、5% CO2条件下培养至对数生长期。取对数生长期的肝细胞, 稀释到终浓度为1 ×105个/ml, 分为0 Gy、2 Gy、4 Gy、6 Gy、8 Gy、10 Gy6个剂量点, 在冰浴下用中国辐射防护研究院的60Co辐照装置照射, 吸收剂量率为0.33 Gy/min。照射后取部分细胞培养至24和48h进行细胞凋亡检测。各剂量点剩余细胞经0.25%胰酶消化后, 用RP M1640培养基对其进行梯度稀释, 将一定数量的细胞植入培养皿中, 放入恒温培养箱中培养20d, 待其长出细胞克隆后, 进行凋亡检测。培养至25d, 于冰浴下统一给予2 Gy的二次照射, 对照射后24h和48h的7702细胞进行细胞凋亡检测。
1.4 流式细胞术检测细胞凋亡[4]本研究采用Annexin-V-PI复染法进行细胞凋亡检测。每个样品收集2 ×105个细胞, 用P B S洗涤细胞二次, 用500 μL的Binding Buffer悬浮细胞, 加入5 μL AnnexinV-FITC, 混匀后加入5 μL PI (Propidi-umIodide), 混匀, 室温避光反应15 min后1h内利用流式细胞仪进行细胞凋亡检测, 激发波长E x=488 nm, 发射波长E m= 530 nm。
1.5 统计学处理采用Origin7.5软件进行数据统计分析与作图。数据表示为平均值±标准差(-x±s), 细胞凋亡百分率组间比较采用单因素方差分析。
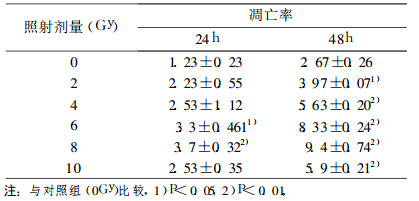
2 结果 2.1 60Coγ射线照射后细胞凋亡的直接检测7702细胞经60Coγ射线照射后, 于照射后24h和48h分别测定凋亡率, 结果见表 1和图 1。由图中可以看出, 随照射剂量的增加, 两个时间点的细胞凋亡率亦明显增加, 且均高于对照组, 在0 ~ 8 Gy之间有一定的剂量相关性。由于10 Gy的照射剂量较大, 细胞出现较高的死亡率, 因此, 受照10 Gy细胞的早期凋亡率有所回落。另外, 从图中亦可以看出受照后48h的细胞凋亡率明显高于24h的细胞凋亡率。
|
|
表 1 首次照射后不同时间细胞凋亡率 |
|
图 1 首次照射后不同时间细胞凋亡率 |
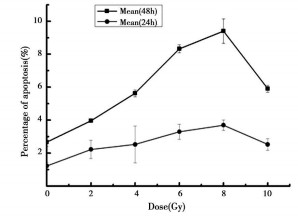
受照后各剂量组细胞经克隆化处理后, 进行细胞凋亡测定, 以未经照射的克隆细胞作为对照组, 结果见表 2和图 2。结果表明:受照后培养至20d的克隆细胞凋亡率仍高于对照组, 且随着首次照射剂量的增大, 细胞凋亡率增加, 二者存在明显的剂量-效应关系。其剂量效应关系符合方程: Y=0.86032 +0.11289X+ 0.0431X2, R值为0.98053。与首次照射后不同时间的凋亡率相比, 克隆子代细胞的凋亡率均有所下降, 但仍高于对照组, 上述结果说明细胞照射后, 虽然启动了DNA修复机制, 但损伤依然存在, 并随着细胞分裂传递到子代细胞中。
|
|
表 2 照射后克隆传代细胞凋亡率 |
|
图 2 照射后克隆传代细胞凋亡率 |
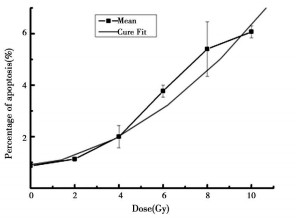
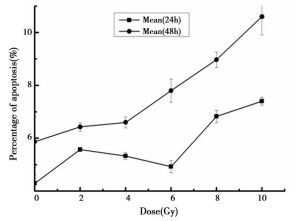
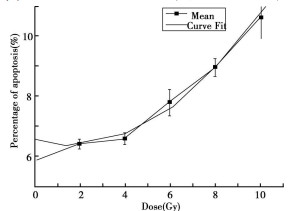
为了进一步证实受照细胞克隆子代中凋亡的变化规律, 在传代至25d时, 对首次照射中各剂量组的克隆子代细胞统一给予2 Gy的二次照射, 并分别于照射后24和48h观察细胞凋亡。结果表明:两个时间点的细胞凋亡率均高于对照组, 且与初始受照射剂量相关。其中, 48h细胞凋亡率具有明显的剂量-效应关系, 其剂量-效应关系符合方程: Y=6.49817-0.18424X+0.06098X2, R值为0.98649。结果见表 3和图 3、4。
|
|
表 3 2Gy二次照射后不同时间细胞凋亡率 |
|
图 3 2Gy二次照射后不同时间细胞凋亡率 |
|
图 4 2Gy二次照射48h后细胞凋亡率 |
电离辐射导致细胞损伤主要为细胞主动反应所导致的细胞凋亡, 受辐射后肿瘤和正常组织的反应是基于辐射诱导的细胞凋亡效应。当细胞受到辐射后, 至少有两种信号-靶系统被激活:一种出现于细胞膜上, 另一种起始于DNA。当然也可能存在起始于细胞胞浆的信号系统。信号传递最终导致细胞修复反应或细胞凋亡[5]。本实验采用Annexin-V-PI复染法、流式细胞术对受照肝细胞7702进行凋亡检测, 对其剂量-效应关系进行研究。磷脂酰丝氨酸(PS)能与连接素(AnnexinV)发生特异性结合。碘化丙啶(PI)为核酸荧光染料, 不能通过正常细胞膜, 只能进入已经破损的细胞膜。细胞发生凋亡时, 其细胞膜的磷脂对称性改变而使PS暴露于细胞膜外, 且凋亡细胞仍然保持其细胞膜的完整性, 因而能与Annexin-V结合, 而不能结合核酸荧光染料PI; 仍保留细胞膜结构的坏死细胞虽PS不发生翻转, 但由于其细胞膜的通透性发生改变, Annexin-V仍能进入细胞内与细胞膜内表面的PS结合, 但同时也能被PI着色; 晚期凋亡细胞因PS外翻和膜通透性改变, 被Annexin-V和PI标记, 也呈Annexin+/PI+; 正常细胞因细胞膜完整且不发生PS翻转现象, 所以不能被Annexin-V和PI标记, 表现为双阴性[4, 6]。因此Annexin-V和PI的匹配使用, 利用流式细胞术进行双参数分析, 可以将凋亡细胞与坏死细胞区分开来。
辐射诱发细胞DNA损伤及修复是影响细胞存活及死亡的主要原因。因为细胞缺乏修复能力, 其辐射敏感性就会增加。目前认为双链DNA的断裂是辐射所致细胞凋亡的最重要损伤形式, 而它的修复是通过重组修复进行的。辐射诱发细胞凋亡的起始刺激不仅作用于DNA分子, 而且还作用于细胞表面受体或胞浆的靶标, 从而引发细胞凋亡的启动[5]。本研究对2 Gy、4 Gy、6 Gy、8 Gy、10 Gy五个剂量组进行细胞凋亡率的统计分析, 结果表明各剂量组与对照组相比具有较高的凋亡率, 照射剂量与细胞凋亡存在明显的剂量-效应关系, 即:随着照射剂量的增大细胞凋亡率递增。受照剂量增大到一定程度将会造成细胞的急性损伤致死, 故本研究中首次照射10 Gy剂量组较8 Gy剂量组的细胞凋亡率有所回落。另外, 结果还显示辐照24h细胞已经出现凋亡, 随着时间的推移, 48h的细胞凋亡率较24h有明显的提高, 且48h细胞凋亡率具有较好的剂量-效应关系。说明细胞受到一定剂量的辐射后可产生持续的损伤, 通过数次细胞分裂后才能发生凋亡, 即辐射与细胞凋亡之间存在一个滞后调节点。
延迟凋亡是指细胞在经过多次复制后的死亡, 具有明显的凋亡特征, 如基因组DNA凝聚降解; 在DNA损伤修复中具有重要作用的Poly(ADP-ribose)Polymerase(PARP)被剪切失活; P53和Bax蛋白高表达。延迟凋亡在很大程度上引发了P53介导的凋亡, 从而减少或消除了修复不完全的情况, 从根本上减少了“不稳定”细胞恶性转化趋势。那些避开了P53介导途径或未形成足够损伤的细胞将会恶性转化[7, 8, 9]。本研究发现克隆化传至20d的受照细胞克隆子代与对照组相比, 仍然具有较高的凋亡率, 且凋亡率与首次照射剂量具有明显的剂量-效应关系, 但凋亡率明显低于首次照射的细胞凋亡率。这说明辐射可能使控制细胞凋亡的一些重要基因发生了改变, 从而使这些细胞出现延迟凋亡。为了进一步证实与说明受照细胞克隆子代中凋亡的变化规律, 再次给予克隆化的传至25d的一次受照细胞2 Gy的二次照射, 并测定其凋亡率。结果显示二次受照细胞的凋亡率并不因接受相同剂量照射而表现出无显著差异, 各组的凋亡率却与一次受照剂量明显相关。上述结果表明辐射使细胞敏感性增加, 所产生的损伤使整个基因组处于一种不稳定状态, 可以传递到细胞的子代中, 持续影响子代细胞的遗传效应。这种不稳定性不仅使细胞对辐射的敏感性提高, 而且可以促进辐射损伤的累积, 诱发一些与癌症相关的重要基因发生突变而最终导致细胞癌变。本项研究为探讨辐射诱发基因组不稳定性所产生的延迟效应机制提供了重要的实验依据。
| [1] |
CarsonDA, R ibeiroJ M. Apoptosis and disease[J]. L ancet, 1993, 341(8855): 1251-1254. |
| [2] |
陆克义. 辐射与凋亡[J]. 山西医科大学学报, 2004, 35(3): 311-313. |
| [3] |
杨龙, 许祥裕, 赵国良, 等. 电离辐射激活细胞膜受体凋亡信号通路[J]. 中国辐射卫生, 2006, 15(2): 133-137. DOI:10.3969/j.issn.1004-714X.2006.02.003 |
| [4] |
梁智辉, 朱慧芬, 陈九武. 流式细胞术基本原理与实用技术[M]. 武汉: 华中科技大学出版社, 2008: 60-68.
|
| [5] |
韩春山, 梁军, 姚如永. 电离辐射效应与细胞凋亡的调控研究进展[J]. 齐鲁医学杂志, 2004, 19(6): 556-557. DOI:10.3969/j.issn.1008-0341.2004.06.056 |
| [6] |
张萱, 刘扬, 王珍琦, 等. 电离辐射对J urkatT细胞凋亡与坏死的影响[J]. 吉林大学学报, 2007, 33(5): 782-785. |
| [7] |
Trucco C, Rolli V, Oliver F J, et al. A dual approach in the study of poly (ADP-ribosyl) polymerase: in vitro random mu-tagenesis and generation of deficient mice[J]. Mol Cell Bio-chem, 1999, 193: 53-60. |
| [8] |
Tatsumi-Miyajima J, Kupper J H, Takebe H, et al. Trans dominat in hibition of poly (ADP-ribosyl) ation poten tiatesal-kylation-induced shuttle-vector mutagenesis in Chinese hamster cells[J]. MolC ell Biochem, 1999, 193: 31-35. DOI:10.1023/A:1006935404987 |
| [9] |
Mendonca M S, Howard K L, Farrington D L, et al. Delayed ap-optotic responses assoc iated with radiation-induced neop lastic trans formation of human hybrid cell[J]. Cancer Res, 1999, 59(16): 3972-3979. |