随着经济的发展和物质文化生活水平的不断提高, 各种家用电器——电视机、空调器、电脑、手机等已经成为现代都市家庭不可或缺的东西。然而, 各种家用电器和电子设备在使用过程中会产生多种不同波长和频率的电磁波。在特定条件下, 这些电磁波可能成为"电磁污染", 危害到人们的健康。
电磁污染危害人体的机理, 电磁污染危害人体的机理主要是热效应、非热效应和累积效应等。热效应:人体70%以上是水, 水分子受到电磁波辐射后相互摩擦, 导致体温升高, 从而影响到体内器官的正常工作。非热效应:人体的器官和组织都存在微弱的电磁场, 一旦受到外界电磁场的干扰, 处于平衡状态的微弱电磁场将遭到破坏, 人体也会遭受损伤。累积效应:热效应和非热效应对人体的伤害具有累积效应, 其伤害程度会随时间和影响程度发生累积, 久而久之会成为永久性病态。对于长期接触电磁波辐射的群体, 即使电磁波功率很小、频率很低, 也可能被诱发意想不到的病变[1, 2]。
本研究探讨了极低频电磁场对小鼠免疫功能影响, 以BALB/c小鼠为研究对象, 利用极低频电磁场对正常小鼠进行辐射, 并检测对各组非特异性免疫功能和体液免疫功能的影响。利用ELISA方法测量血清中IgG抗体的水平。通过对极低频电磁辐射对小鼠体液和细胞免疫功能影响的检测, 以此来探讨极低频电磁场的生物效应。这一研究可以为制定电磁辐射对人类健康的标准提供有价值的数据。
1 材料与方法 1.1 材料 1.1.1 试验动物及分组选择BALB/c小鼠为研究对象, 由上海实验动物中心标准配方块状饲料喂养, 暴露期间动物自由饮水、摄食, 室温控制在(20 ±2)℃, 相对湿度30%~60%。试验组根据极低频电磁场暴露的参数和暴露的时间不同分为8组, 每组10只, 对照组10只小鼠除不受电磁场暴露外, 其余条件与暴露组相同。
1.1.2 极低频电磁场极低频电磁场发生器装置主要由电磁铁平台和电源控制柜构成, 由华东师范大学科教仪器厂研制生产。电磁铁平台(28.0cm×25.5cm×22.0cm)由439匝中心线圈、80匝补偿线圈并绕的电磁铁构成, 24h连续运行本体温度不超过20℃。线圈所在空间区域经测试确认电磁场分布均匀, 构成暴露区。电源控制柜对调压变压器、定时继电器以及可调稳压电源进行操作, 暴露强度为0~10mT连续可调。
1.2 实验方法 1.2.1 极低频电磁场暴露试验组根据极低频电磁场暴露的参数和暴露的时间不同分为8组, 每组10只, 暴露-间断各2h为一周期。其中暴露参数分为1.0mT、4.5mT、9.0mT (以CT3A型特斯拉计和SR-12A示波器监测), 持续时间分别为8周和12周。对照组10只小鼠不受电磁场暴露。
1.2.2 脾脏和胸腺指数的检测暴露结束后, 按先后顺序将不同组小鼠颈椎脱位处死之后, 立即称取小鼠体重, 取出胸腺和脾脏, 并称胸腺、脾脏的重量, 计算胸腺和脾脏的脏器指数。

|
试验结束后各组取5只小鼠腹腔注射1ml5%可溶性淀粉溶液, 3d后腹腔注射7 × 109个/ml白色葡萄球菌溶液0.3ml。20min后腹腔液涂片、染色, 在油镜下计数腹腔巨噬细胞吞噬白色葡萄球菌的情况:吞噬率=(吞噬细菌的巨噬细胞数/计数的巨噬细胞总数)× 100%, 吞噬指数=巨噬细胞吞菌的总数/吞菌的巨噬细胞数。
1.2.4 对体液免疫功能影响的检测-用ELISA方法检测IgG抗体水平暴露试验结束之后, 对各组鼠分别通过眼内眦静脉取血。血标本37℃孵育4h, 8 000rpm离心10min, 收集血清转移另一无菌管中, 55℃孵育30min后置于-20℃备用。检测鼠的IgG抗体的血清学检测使用的ELISA试剂盒购于北京华大吉比爱生物工程公司, 操作按说明书进行。
1.2.5 统计学处理数据以x±s表示, 采用t检验、χ2检验方法检验组间的差异显著性。通过SPSS11.0统计学软件包进行多元素分析, 观察接触不同剂量、不同时间极低频电磁场小鼠免疫功能的影响。
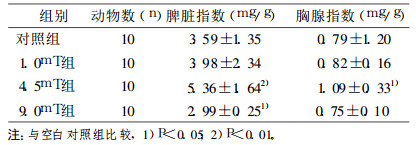
2 结果 2.1 暴露8周试验组的检测结果 2.1.1 电磁波对小鼠胸腺、脾脏器指数的影响不同剂量8周时间的照射后, 小鼠体重下降, 睥脏指数有所增加, 但低剂量处理组增长较少, 与对照组比较差异无统计学意义(P>0.05), 中浓度处理组与对照组比较增长幅度最大, 差异有统计学意义(P < 0.05), 高剂量处理组胸腺指数反而低于对照组, 与对照组的差异有统计学意义(P < 0.05), 说明高剂量可使小鼠脾脏变小。不同剂量相同时间的照射后, 胸腺脏器指数有所增加, 但低剂量处理组与对照组比较, 差异有统计学意义(P < 0.05), 中浓度处理组与对照组比较是增加, 差异有统计学意义(P < 0.05), 高剂量处理组胸腺指数低于对照组, 与对照组的差异有统计学意义(P < 0.05), 说明高剂量可使小鼠胸腺变小, 结果见表 1。
|
|
表 1 极低频电磁辐射对小鼠胸腺指数、脾脏指数的影响 |
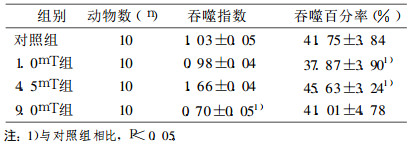
照射结束后, 试验组小鼠腹腔巨噬细胞吞噬率以低、高呈下降趋势, 与对照组相比差异无统计学意义(P>0.05);中剂量处理组反而略有升高的趋势, 但是与对照组相比差异没有统计学意义(P>0.05);小鼠腹腔巨噬细胞吞噬指数呈下降趋势, 高剂量处理组显著性降低(P < 0.05)。结果见表 2。
|
|
表 2 极低频电磁场对正常小鼠和免疫抑制小鼠巨噬细胞吞噬功能的影响 |
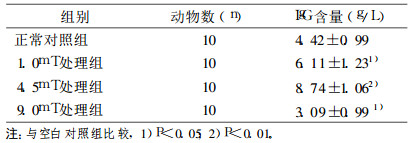
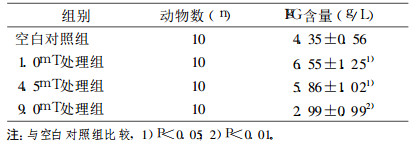
在小鼠低、中剂量电磁波照射组中, 象征体液免疫水平的IgG抗体的水平逐渐升高的趋势, 但是在高剂量的照射条件下, IgG抗体的水平与正常对照组相比较却是下降的。结果见表 3。
|
|
表 3 极低频电磁场对小鼠体液免疫功能的影响(血清IgG含量的影响) |
不同剂量12周时间的照射后, 小鼠体重下降, 睥脏指数由增加变为减少, 低剂量处理组睥脏指数增加, 但与对照组比较差异无统计学意义(P>0.05), 中剂量处理组与对照组比较增长幅度大, 差异有统计学意义(P < 0.05), 高剂量处理组胸腺指数反而低于中剂量, 与对照组的差异有统计学意义(P < 0.05), 说明高剂量可使小鼠脾脏变小。不同剂量12周时间的照射后, 但低剂量处理组与对照组比较, 胸腺指数有所增加, 差异无统计学意义(P>0.05), 中浓度处理组与对照组比较, 差异有统计学意义(P < 0.05), 高剂量处理组胸腺指数反而低于中剂量, 接近对照组, 与对照组的差异无统计学意义(P>0.05), 说明高剂量可使小鼠胸腺变小。结果见表 4。
|
|
表 4 极低频电磁辐射12周对小鼠胸腺指数、脾脏指数的影响 |
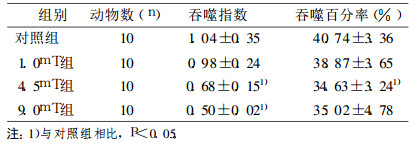
12周辐射结束后, 低剂量处理组小鼠腹腔巨噬细胞吞噬指数和吞噬率有所下降, 但是与对照组相比差异无统计学意义(P>0.05);中剂量处理组与高剂量处理组都呈下降的趋势, 与对照组相比差异有统计学意义(P < 0.05);与高剂量处理组巨噬细胞吞噬指数也呈下降趋势, 与对照组相比差异有统计学意义(P < 0.05), 结果见表 5。
|
|
表 5 极低频电磁场对正常小鼠和免疫抑制小鼠巨噬细胞吞噬功能的影响 |
ELISA试验的结果表明, 小鼠低剂量长时间(12周)的电磁波的暴露下, 象征体液免疫水平的IgG抗体水平是升高的, 但是在中、高剂量的照射条件下, 与8周时相比IgG抗体的水平与正常对照组相比较却是下降的(P < 0.05), 结果见表 6。
|
|
表 6 极低频电磁场对小鼠体液免疫功能的影响(血清IgG含量的影响) |
电磁波可通过对免疫器官、组织和细胞的直接作用而影响机体的免疫功能, 胸腺作为中枢免疫器官对各种刺激非常敏感, 应激反应、药物、激素及各种疾病等因素均可导致起其迅速发生器质和功能的改变[3, 4]。本研究使用了1.0mT、4.5mT、9.0mT三个不同的照射剂量, 与对照组比较而言, 尤其是高剂量组表现为胸腺萎缩, 胸腺萎缩可降低胸腺激素活性及T淋巴细胞活性。本研究结果发现, 胸腺在低、中剂量的处理后, 表现为胸腺脏器指数增加的现象, 也就是胸腺脏器脏器的增生, 但是高剂量组却是相反, 这证明长时间的照射随着剂量的增加会导致免疫功能的抑制,
主要是导致细胞免疫功能抑制可能与胸腺细胞过度凋亡进而使得胸腺激素活性及T淋巴细胞活性下降, 最终引起小鼠细胞免疫功能出现抑制, 并非是由于T淋巴细胞减少所致[5]。脾脏是最大的淋巴器官, 具有重要的免疫功能, 是各类免疫细胞居住的主要场所, 既是对抗原物质产生免疫应答及产生免疫效应物质(如抗体等)的重要基地, 又是合成免疫物质的重要场所[6]。研究表明, 电磁波可引起脾脏免疫细胞超微结构的改变, 可见脾脏免疫细胞出现不同程度线粒体肿胀、空泡化或固缩。单核巨噬细胞系统, 具有广泛的生物学功能, 如抗感染、抗肿瘤、参与免疫应答和免疫调节, 巨噬细胞吞噬功能的变化可以反映机体体液免疫功能的改变[7, 8]。本实验结果表明, 高剂量处理组小鼠巨噬细胞吞噬率明显降低, 并有良好剂量反应关系, 提示低剂量仍然对小鼠产生体液免疫抑制作用。高剂量处理组可诱导脾脏细胞凋亡率显著增加, 提示由于脾脏细胞过度凋亡可能会影响脾脏内B淋巴细胞的结构和功能, 抑制脾脏的正常功能, 最终影响其抗体的合成、分泌, 导致机体体液免疫功能抑制。有研究证明, 在强磁场暴露下, 免疫功能降柢、但长期暴露在弱磁场, 却有增强; 还有研究表明, 小鼠在工频高压电磁场下, 非特异性免疫功能有短暂增高期, 巨噬细胞吞噬功能下降, 提示低强度短时间磁场也会对免疫功能产生一定影响。造成这些研究结果的不一致, 与暴露磁场强度、均匀度、个体差异及淋巴细胞、巨噬细胞调节机理不同可能有关。虽然如此, 但也提示极低频磁场对免疫功能是有影响的。有关磁场的作用机制还有待进一步研究。
| [1] |
谢漪, 党秉荣, 张红, 等. 辐射免疫学研究进展[J]. 原子核物理评论, 2005, 22(3): 288-291. DOI:10.3969/j.issn.1007-4627.2005.03.013 |
| [2] |
黄德娟, 黄德超, 廖晓峰, 等. 天然抗辐射物质抗损伤作用研究进展[J]. 中国辐射卫生, 2008, 7(4): 511-512. DOI:10.3969/j.issn.1004-714X.2008.04.075 |
| [3] |
卢连华, 周景洋, 颜燕, 等. 纳米硒的免疫调节及辐射防护作用研究[J]. 中国辐射卫生, 2009, 18(2): 161-163. |
| [4] |
王宁, 李应东, 刘凯. 当归、黄芩及其有效成分抗辐射作用的研究概况[J]. 中国辐射卫生, 2008, 17(1): 121-122. DOI:10.3969/j.issn.1004-714X.2008.01.068 |
| [5] |
George AJ, Ritter MA. Thymic involution with aging:obsolescence or good housekeeping[J]. Immunol Today, 1996, 17: 267-272. DOI:10.1016/0167-5699(96)80543-3 |
| [6] |
Hirokawa K, Makinodan T. Thymic involution:effect on T cell differentiation[J]. J Immunol, 1975, 114: 1659-1664. |
| [7] |
Junko Toki, Yasushi Adachi, Tienan Jin, et al. Enhancement of IL-7 following irradiation of fetal thymus[J]. Immunobiolog, 2003, 207(4): 247-256. DOI:10.1078/0171-2985-00242 |
| [8] |
Brunelli R, Frasca D, Spano M, et al. Gonadectomy in old mice induces thymus regeneration but does not recover mitotic responsiveness[J]. Ann N Y Acad Sci, 1992, 673: 252-255. DOI:10.1111/nyas.1992.673.issue-1 |