脾脏是机体最大的免疫器官, 含大量淋巴细胞, 以B淋巴细胞为最多, 主要分布在脾小体边缘区和红髓。淋巴细胞具有很高的辐射敏感性, 其中B细胞较T细胞具有更高的照射后凋亡敏感性。B细胞表面具有识别抗原的受体和有丝分裂原受体, 在特异性抗原刺激下可使相应淋巴细胞克隆发生增殖。脂多糖(LPS, 对小鼠有作用)可刺激B细胞发生增殖, B淋巴细胞增殖和分化是机体免疫应答过程的一个重要阶段, 是衡量机体体液免疫力的重要指标。丝裂原活化蛋白激酶(mitogen -activated protein kinases, MAPKs)是一类在脊椎动物体内广泛存在的细胞内丝氨酸/苏氨酸蛋白激酶, 其参与的细胞内激酶级联反应是细胞外界信号传递到细胞核内、调节基因表达的重要通路。MAPKs包括3个主要的亚家族:细胞外信号调节激酶(ERK)、c-Jun氨基末端激酶(JNK)和p38 MAPK。p38是1994年由Han等发现的一种38kD的酪氨酸磷酸化蛋白激酶, 由360个氨基酸组成, p38-MAPK通路的活化与细胞的凋亡和细胞周期调节密切相关[1]。本研究拟从体内、体外实验, 研究不同剂量电离辐射对小鼠脾细胞活性的影响, 探讨阻断p38MAPK通路对小鼠脾细胞的防护和治疗作用。
1 材料和方法 1.1 试剂、材料和仪器淋巴细胞分离液(Ficoll), 天津美德太平洋科技有限公司。Celltiter-Glo, Promega, Cat.G756B, Lot.19681810。LPS, Sigma; SB203580, LCLab, cat.s-3400, Lot.arv-107。RPMI-1640, Solarbio, cat.31800-500, Lot. 215445。胎牛血清, Biovision, cat.04-001-1A, Lot.215445。CO2培养箱, Heraells。多功能酶标仪, TECAN, InfiniteM200。137Csγ射线照射源, 加拿大原子能有限公司, 型号USD, Autocell40, 剂量率0.82Gy/min。Eppendorf离心机, 型号5810R。
1.2 实验动物C57BL/6小鼠, 雄性, 21~23g, 购自维通利华, 合格证号:SCXK (京)2008-0003。
1.3 实验方法 1.3.1 体外实验取C57BL/6小鼠4只称重, 颈椎脱臼法处死, 常规消毒后, 在超净工作台中无菌取出脾脏, 称重后置含10%胎牛血清的RPMI-1640培养液中, 制取脾细胞悬液后Ficoll分离, 台盼蓝鉴定细胞活性(在95%以上), 计数后用RPMI-1640培养液调细胞浓度为2 ×106/ml备用。用0、1、4Gy剂量的γ射线照射后6h后进行脾细胞增殖实验, 细胞悬液加入96孔板, 每孔100μl, LPS刺激组加入用1640液稀释的10μl/mlLPS100μl, 对照组加入1640液100μl, 于37℃培养48h后加入Celltiter-Glo震荡孵育10min转入96孔白板, 多功能酶标仪检测发光值(luminescence功能, Integration1000ms)。刺激指数(S.I.)计算方法:
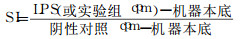
|
取C57BL/6小鼠24只分3组, 分别用0、4、6Gy剂量的γ射线照射, 1天后脱颈处死, 无菌条件下取脾细胞, 制成2 ×106/ml单细胞悬液进行脾细胞增殖实验(方法同上)。
1.3.3 体内药物防护实验取C57BL/6小鼠32只, 分对照组(Ctr组)、照射对照组(IR组)、药物治疗组(SB-C组)和药物预防组(SB-P组)。SB-P组于照射前0.5h按15mg/kg皮下注射SB203580工作液, 后3组用7.2Gy剂量的γ射线照射, SB -C和SB-P组照射24h后腹腔给药, 隔日1次, 共5次, Ctr组和IR组于相同时间皮下注入等量DMSO液; 照射15d后处死小鼠, 取脾细胞进行脾细胞增殖实验, 方法同上。
1.4 统计学处理数据处理用SPSS11.5版软件包进行分析, 检测结果以x±s表示, 经Levene检验后, 采用LSD法检验比较组间差异, P < 0.05为差异有统计学意义。
2 结果 2.1 体外实验在体外实验中, 电离辐射能够显著降低小鼠脾细胞的增殖能力, 1Gy和4Gy组均较对照组显著下降(P < 0.05), 1Gy和4Gy组间差异有统计学意义(P < 0.05)。见图 1。

|
图 1 不同剂量辐射体外实验对小鼠脾细胞增殖能力影响 |
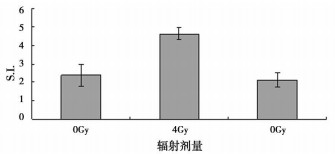
实验结果显示, 在电离辐射急性期, 小鼠脾脏功能受到影响, 4Gy组S.I.值较对照组增高93.1%, 6Gy组较对照有所降低, 没有统计学意义(P>0.05), 较4Gy组降低53.9%, 差异有统计学意义(P < 0.05)。见图 2。
|
图 2 体内急性期不同剂量辐射对小鼠脾细胞增殖能力影响 |
在体内药物防护实验中, 采用亚致死剂量的γ射线对实验小鼠进行了照射, 实验中有近半数的照射小鼠死于胃肠道损伤。由存活的小鼠研究发现, 小鼠经亚致死剂量电离辐射后脾细胞增殖能力下降, SB203580治疗后其增殖能力有所上升, 但较照射组无统计学意义差异, SB203580预防组较照射组增高77.7%, 差异有统计学意义(P < 0.05)。见图 3。

|
图 3 体内SB203580干预实验 |
由图 1可见, 在体外实验中, 电离辐射可以降低小鼠脾细胞免疫活性, 随照射剂量增大其损害作用增强, 其原理可能在于:电离辐射可以直接破坏DNA双链, 导致细胞凋亡[2]; 电离辐射可在细胞内产生大量活性氧, 诱发细胞凋亡[3]。由图 2的数据表明, 在体内实验时的情况与体外实验不同, 在4Gy剂量时脾细胞的活性反而增强, 6Gy剂量时脾细胞活性较4Gy时显著下降, 而与对照组处于相同水平, 这一结果与KlokovD等[4]的研究结果相似。其原因在于当脾脏受到低剂量辐射时, 可引起免疫应答的发生, 脾的体积和内部结构也发生变化, 使脾脏成为具有一定辐射保护作用的免疫应答场所[5]。
SB203580预防组较照射组的S.I.值升高77.7%, 差异有统计学意义(P < 0.05)。活化的P38可以直接磷酸化P53, 磷酸化的P53不能被其抑制蛋白HDM2结合和降解, 因此含量增高, 能活化靶基因P21WAF1的转录, 有效地将细胞周期阻滞在G1、G2期[6]。P21与周期蛋白-CDK复合物结合, 可以抑制CDK1、2、4的活性使细胞阻滞与G2/M关卡处[7]。可见, 阻断p38-MAPK通路后, 可以降低各级造血细胞所处G2/M期的比例, 提高G1/0期的比例, 而细胞处于G2/M期对辐射较敏感, 处于G1/0期时对辐射的耐受力较强。所以, 我们认为, 应用SB203580可以预防辐射对小鼠脾细胞的损伤, 从而提高机体的体液免疫力。
在今后的研究中, 我们将对P38-MAPK通路的上游活化因子和下游与细胞周期、细胞凋亡的相关效应蛋白进行深入研究, 并探讨该通路与TGF-beta/Smads、P53等细胞信号传导通路的交互作用, 为临床应用提供更多依据。
致谢: 常建辉, 翟志斌, 刘金剑, 王彦, 褚丽萍等为我们提供的帮助。
| [1] |
Han J, Sun P. The pathways to tumor suppression via route p38[J]. Trends Biochem Sc, 2007, 32: 364-371. DOI:10.1016/j.tibs.2007.06.007 |
| [2] |
Mognato M, Girardi C, Fabris S, et al. DNA repair in modeled microgravity:double strand break rejoining activity in human lymphocytes irradiated with gamma-rays[J]. Mutat Res, 2009, 26(1-2): 32-39. |
| [3] |
Liu Q, He X, Liu Y, et al. NADPH oxidase-mediated generation of reactive oxygen species: A new mechanism for Xray-induced HeLa cell death[J]. Biochem Biophys Res Commun, 2008, 377(3): 775-779. DOI:10.1016/j.bbrc.2008.10.067 |
| [4] |
Klokov D, Criswell Sampath L, et al. Clusterin:a protein with multiple functions as a potential ionizing radiation exposure marker[J]. Radiation Life Sciences, 2003, 16(24): 219-32. |
| [5] |
Yang ZW, Li JA, Yang MH, et al. Comparison of blood counts in splenic, renal and mesenteric arterial and venous blood in post-pubertal rabbits[J]. Res Vet Sci, 2005, 79(2): 149-154. DOI:10.1016/j.rvsc.2004.11.008 |
| [6] |
el-DeiryWS, Harper JW, O'Connor PM, et al. WAF1/CIP1 is induced in p53-mediated G1 arrest and apoptosis[J]. Cancer Res, 1994, 54: 1169-1174. |
| [7] |
Chen WJ, Chang CY, Lin JK. Induction of G1 phase arrest in MCF human breast cancer cells by pentagalloylglucose through the down-regulation of CD K4 and CD K2 activities and upregulation of the CD K inhibitors p 27(Kip) and p 21(Cip)[J]. Biochem Pharmacol, 2003, 65: 1777-1785. DOI:10.1016/S0006-2952(03)00156-4 |



