全身放射治疗(Total Body Irradiation, TBI)是肿瘤放射治疗中一种有别于常规照射的大野照射技术。由于全身放射治疗在骨髓移植中的三大作用[1]:①根除机体内残存的恶性肿瘤细胞; ②抑制受体免疫功能, 减低受体对移植物的排斥, 使植入的造血干细胞能成活; ③彻底破坏受体骨髓, 使受体骨髓空虚, 以利于植入的造血干细胞生长。因此, 全身照射是骨髓移植治疗白血病预处理中极为主要的手段之一, 效果肯定, 目前尚无其他手段替代。
1 全身放射治疗剂量学TBI (全身放射)剂量学的复杂性主要是由所要照射体积的复杂性, 大野照射和远距离照射引起的[2]。本研究采用以实际测量剂量值为基础, 根据患者的CT信息数据进行相对剂量分布和绝对剂量的计算。实际测量值主要是在水模体内测量所得剂量值, 即全身照射条件下的基础剂量学参数。
1.1 剂量计算模型基础剂量学参数, 都是在均匀的长方体(或立方体)的水模体内测量得到的, 而患者的身体不是由均匀的组织组成, 而且其呈不规则的形状, 因此测量所得的剂量值与实际患者体内的剂量分布存在着差异。考虑患者身体的面积和形状(有效照射野的面积, 这将决定散射条件)以及组织成分和密度, 系统在剂量计算时必须对测量值进行校正。B. Sanchez-Nieto[3]等研究发现任何点的PDD值与患者身体的厚度有关。进一步研究发现BCF和LCF都与计算点的深度线性相关, 而与点到反向和侧向出射线的距离成指数关系, 如表 1所示。由BCF和LCF定义可知, 只需将PDD乘以BCF和LCF进行校正即可。
|
|
表 1 半试验模型计算散射校正因子, BCF、LCF |
研究文献发现[4], 有许多方法可用于组织不均匀性校正(LFC)。本研究采用公式(1)模型计算LCF的值。
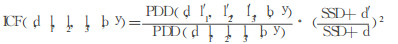
|
(1) |
其中, d, l1, l2, l3和b是物理深度, 分别代表计算点到反向表面和侧向表面的距离以及反向散射厚度, 而d', l1', l2', l3'和b'(有效深度、距离和厚度)其值等于相同的物理量与组织相对于水的电子密度的乘积。公式1中的PDD值由前面提到的基础剂量测量所得到后, 再由表 1中的散射校正因子校正后所得值。公式1所示的LCF是电子密度法(ESSD)[4]。所得到的LCF不仅考虑了原射线方向的衰减, 而且对由于侧向不均匀性造成的散射进行了修正。
因此, 患者体内任意一点P点剂量率计算见公式(2):
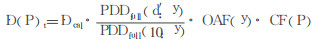
|
(2) |
其中, PDDfull代表在全散射条件下所测得的PDD值, CF (P)表示所有校正因子集合。CF (P)主要由TBI条件下得到的散射校正因子组成[5], 见公式(3):
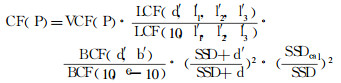
|
(3) |
此时计算得到的剂量值是假设人体横断面为规则矩形。实际上, 人体横断面是不规则的曲面, 如图 1所示。因此, 一些物理量如定义点的深度, 散射厚度不能代表实际情况。为了解决这个问题, 从而进一步的提高剂量计算值的准确性, 公式(4)可以计算有效的散射厚度。

|
(4) |

|
图 1 人体横断面 |
其中, θi和li如图 1所示。
1.2 全身放射治疗剂量计划系统软件设计系统按照软件工程设计思想设计, 操作流程主要为:患者信息的登记与管理、患者CT图像录入、建立三维坐标、选择剂量参考点、剂量计算、显示等剂量分布、剂量优化、输出治疗计划和图文报告。系统设计以MicrosoftVisualC++为主要开发工具, MATLAB为辅助工具。选用易于管理, 扩展性好的MicrosoftSQLServer2000为后台数据库, 用于存放治疗信息。本系统的主要功能模块如下:
1.2.1 患者信息管理患者信息录入、修改和删除, 同时记录CT图片的文件路径, 生成矢状面、冠状面的参数设置。
1.2.2 二维CT图像处理从CT图片中提取DICOM信息, 用于显示和剂量计算, 如医院、层厚、像素大小、图像大小等。
1.2.3 等剂量分布显示根据上述剂量计算模型, 在预定的参考剂量点基础上, 进行散射校正, 组织不均匀性校正以及人体表面曲线校正, 对剂量进行优化计算。最后在CT层面显示等剂量线, 计算鼠标所在点的剂量。
1.2.4 三维重建系统读取CT图像并重建矢状面和冠状面, 计算矢状面和冠状面的中间层上的剂量分布, 显示等剂量线。
1.2.5 剂量优化根据剂量计算结果对患者体内剂量进行优化, 特别是肺部组织的高剂量区必须进行矫正, 在实际应用中一般使用挡铅以降低患者体内剂量, 系统根据肺部剂量计算值与临床处方剂量值, 计算挡铅的厚度。还有, 系统将指出其他不易察觉的高剂量区, 用以提示。
1.2.6 输出治疗计划系统根据不同患者的输入数据, 输出其相应肺部补偿器的厚度和形状及治疗计划(剂量分布示意图)。
CT图像为DICOM格式存放扫描信息, 主要包括医院信息、影像设备信息, 患者基本信息、扫描定位信息、图像数据等。由于DICOM文件是医学图像专用格式, 一般图像浏览工具无法读取它, 为此, 系统采用VTK中的vtkDICOMImageReader类用于DICOM图像的读取。vtkDICOMImageReader类包含的成员函数不仅可以读取DICOM图像数据并用于显示, 而且可以读取DICOM图像存储的患者扫描信息, 系统将读取的患者信息输入患者数据库用以调用。读取CT图像后, 进行二维图像处理, 包括去除图像噪声, 靶区勾画和标识、窗口窗为调整, 放缩, 旋转、伪彩色处理等。
系统以CT横断面得横轴从左到右为X轴正方向, 纵轴从上到下方向为Y轴正方向, 以指向患者头部的方向为Z轴正方向, 以第一张横断面图像的原点为系统三维坐标的原点, 这样CT层面上任一点的三维坐标都相对于原点坐标变换。在此基础是使用VTK技术实现矢状面和冠状面的重建。
2 结果为了实现剂量计算, 系统需要输入两类数据:首先是基本的剂量数据, 这部分数据主要是实验测量得到; 其次是病人数据, 主要由患者的CT图像提供, 实验时我们采用南方医院提供的实际病例数据512 ×512×97的全身CT数据。
放射治疗方案中一个重要的环节是定义靶区和记录分布, 在功能模块中, 最主要的工作是在三维空间中勾勒二维靶区的轮廓。而对于全身放射治疗, 患者的整个身体就是照射靶区, 因此只需对CT图像患者体表轮廓提取。本系统利用VisualC ++语言实现半手工体表轮廓提取。
2.1 剂量计算基本的剂量数据, 包括绝对和相对的剂量学数据, 对于截面剂量和PDD曲线的测量点数目没有严格的限制, 系统会根据输入剂量值自动应用线性插值的方法计算两测量点间的值, 绘制曲线。这部分的数据对于同一放疗中心同一加速器, 在一段时间内其值变化不大, 因此, 对于不同的患者在设计治疗计划时, 并不需要重复输入。
对于每次新的治疗计划, 患者数据——CT图像, 其主要提供了剂量参考点的物理量集合, 包括深度, 离轴距, 反向组织厚度等, 通过CT图像的三维重建, 建立仿真系统, 就在患者的数字图像上测量这些物理量。CT图像不仅提供了患者的解剖信息, 而且利用CT值可计算不同组织结构的相对电子密度, 进一步可得到参考点的有效厚度的值。
实现剂量计算程序的具体步骤如下:
(1) 对于实际病人的全身CT数据, 先对原始数据进行降低分辨率采样得到64 ×64 ×97的CT序列图像。利用自行编写的VisualC++程序读出97个DICOMCT序列图像的各像素CT值。
(2) CT图像的CT值反映组织对X射线吸收值(衰减系数μ)。根据临床放射治疗广为采用的batho法(组织空气校正法), 把人体的密度分为六段, 如图表2所示。根据表2, 将人体密度分为六段, CT值与组织密度在CT值范围内呈非线性变化, 因此进行查表, 将原始的256灰阶的CT图像转换为6灰阶图像, 便于有效厚度的计算。
(3) 剂量计算的单位为体素, 每个体素包括4 ×4个像素, 将每个体素赋值为16个像素的平均电子密度。将初始的a×b的CT值矩阵转化为a/4 ×b/4的相对电子密度矩阵。
(4) 建立仿真人体矩阵信息, 对CT图像作三维重建, 在三维人体坐标下划分网格, 将Z, Y, X各点分为nz, nx, ny点, 即成人体网格矩阵, 人体的网格节点, 或是人体上的点, 或为空间的点。
(5) 利用上述公式(1)~公式(4)计算剂量, 绘制等剂量曲线, 并在CT图像上显示。
2.2 补偿器厚度的计算在全身照射过程中, 由于肺组织密度较低, 因此通常肺部剂量比处方量高出7%~15%[3], 而过高的肺剂量会引发间质性肺炎, 这种并发症无有效的治疗手段, 从而影响TBI的疗效。因此, 患者在接受全身照射时, 肺剂量的控制尤为重要。因此, 在进行全身放射治疗时有必要进行肺屏蔽, 肺铅挡的设置是控制肺剂量减少放射性肺炎的重要措施。由于患者的体厚和肺部组织密度都存在着的个体差异, 因此, 肺部补偿器的厚度和形状也要因人而异。
在TBI治疗条件下, 我们测得补偿器材料铅的线性衰减系数[μ=(0.0391 ±0.0032) cm-1], 系统根据关键器官的限制剂量, 计算补偿器的厚度。射线经补偿器衰减后, 到达肺组织的限定剂量, 从而降低的间质性肺炎发生的概率。
图 2(a)、2(b)分别为未使用肺部补偿器时和使用肺部补偿器后肺部剂量分布图, 该系统可以根据临床实际处方剂量和肺部限制剂量, 计算补偿器的厚度, 在临床使用时, 物理师和临床医生可根据肺部剂量分布图, 来判断计算结果是否符合临床要求, 并且对计算结果进行相应的修改。由于肺组织的密度与其中的空气含量有关, 与患者的治疗体位、年龄也有一定的关系[3], 因此其肺部对射线的吸收也是因人而异, 通过适当地调整补偿器的厚度以满足计划个体化的需要。减少肺组织过剂量或欠剂量的发现, 提高全身放射治疗的效果。

|
图 2 |
在实现患者轮廓提取后, 本系统采用Visual C++与Matlab联合编程实现剂量计算和剂量分布显示。由于全身放射治疗大野照射的特殊性, 剂量计算量十分庞大, 因此利用Matlab矩阵计算的优势进行剂量计算, 再利用Visual C++语言实现剂量计算结果的可视化, 如图 2所示为横断面等剂量曲线。在此界面下还可以单击鼠标右键, 显示任意点的绝对剂量值。
通过横断面的等剂量分布图, 我们不难发现患者体内剂量分布呈中间小而两边大, 这主要有两个原因:首先人体边缘体厚较薄, 正面与背面照射时, 人体边缘剂量衰减较小, 两次照射剂量相加后就使得人体边缘剂量高于中间剂量; 其次, 相对于人体边缘组织, 同一深度处, 人体中间部位组织, 射线被上部分的组织吸收和散射, 也就是说, 对于同一深度处, 中间部分的组织射线衰减较大。而源皮距, 由于是远距离照射影响较小, 可忽略不计。在TBI治疗照射时, 可对体厚较薄的部位进行相应补偿, 从而进一步改善患者体内剂量的均匀性。
本系统采用VTK技术重建CT图像, 获得患者CT图像的矢状面和冠状面。根据先前计算的各个层面的横断面剂量值, 以及CT图像扫描的间距, 输入矢状面或冠状面的重建参数, 计算相应矢状面或冠状面的剂量值, 绘制并显示矢状面或冠状面等剂量曲线, 用以评估剂量分布的均匀性。图 3(a)、(b)分别为系统计算所得矢状面和冠状面的等剂量分布图。分析剂量分布图, 肺部由于没有进行补偿, 为高剂量区, 而患者体内剂量最大值为7.9, 最小值为6.8, 均匀度达到±5%, 符合临床应用的要求。

|
图 3 |
该系统是专门针对全身放射治疗设计的, 考虑了全身放射治疗技术的特殊性——大野照射和远距离照射。系统基本实现了针对个体化病例, 设计出符合临床要求的治疗计划, 并在任意横断面、矢状面、冠状面上的等剂量分布显示, 直观地反映剂量分布与组织器官的相互关系, 定量地计算出CT图像上鼠标所指向的任意一点的剂量值。由于本系统能够更精确的计算出患者体内任意位置的剂量, 更直观的显示剂量分布, 因此在临床应用上具有明显的优势。本系统对于患者人体剂量均匀性的校正, 特别是肺部剂量的校正, 是根据患者CT图像提供的信息设计肺部补偿器, 这也使得全身放射治疗计划更精确, 减少了并发症间质性肺炎的发生。
| [1] |
邹颖. X (γ)线全身照射技术及临床应用[J]. 中国误诊学杂志, 2002, 2: 205. DOI:10.3969/j.issn.1009-6647.2002.02.018 |
| [2] |
Timothy E Schultheiss, PH D, Jeffrey Wong. Image-Guided Total and Total Lymphatic Irradiation Using Helical Tomotherapy[J]. Radiation Oncology Biol.Phys, 2007, 4: 1259-1267. |
| [3] |
B.Shnchez-Nieto. A CT-aided PC-based physical treatment planning of TBI:a method for dose calculation[J]. Radiotherapy and Oncology, 1997(42): 77-85. |
| [4] |
胡逸民. 肿瘤放射物理学[M]. 北京: 原子能出版社, 1999: 217-228.
|
| [5] |
Van Dyk J, Galvin J M, Glasgow G P, et al.The physical aspects of total and half body photon irradiation[J].AAPM Report 17.
|




