2. 中南大学湘雅医院放疗科, 湖南 长沙 410000
Ⅲ期非小细胞肺癌(NSCLC)约占初治肺癌的30%, 大部分患者失去手术机会, 放疗及化疗为主要治疗手段。2002年1月~ 2006年12月, 我科共收治Ⅲ期NSCLC患者186例, 现对164例资料完整的患者进行疗效及预后分析。
1 资料与方法 1.1 临床资料164例Ⅲ期NSCLC患者, 男136例, 女28例; 年龄35 ~ 85岁, 中位年龄64岁, 其中≥ 70岁者57例。均经细胞和(或)组织学证实诊断, 其中鳞癌112例, 腺癌49例, 腺鳞癌3例。临床分期为Ⅲa期62例, Ⅲb期102例。KPS评分≥ 80分者129例, 血红蛋白(HB)≥ 120g/L者125例。
1.2 方法 1.2.1 治疗方法单纯放疗53例, 序贯治疗(先化疗后放疗)72例, 同步治疗(化疗与放疗同时进行)39例。常规放疗照射野包括原发灶、同侧肺门及纵隔, 有锁骨上淋巴结转移者则包括锁骨上及下颈部淋巴引流区。常规分割, 总剂量(DT) 36 ~ 40Gy后缩野针对原发灶及转移淋巴结加量20 ~ 30Gy, 本组29例常规放疗40Gy后行三维适形放疗, 加量26 ~ 34Gy。化疗方案主要为NP方案(NVB 25mg/m2第1、8天, DDP 25 ~ 30mg/ ㎡第1~ 3天, 每28天为一周期)和DP方案〔Docetaxel 75mg/m2第1天, DDP(25 ~ 30)mg/m2第2 ~ 4天, 每28天为一周期〕。序贯治疗者于化疗3 ~ 4周期后进行放疗, 同步治疗者于第1周期化疗第2天开始放疗, 放疗结束再巩固2周期化疗。对影响预后的因素行单因素及多因素分析。计算严重不良反应(3 -4度骨髓抑制及3 ~ 4度食管反应)发生率。
1.2.2 统计学方法采用SPSS11.0软件。生存率用Kapaln-Meier计算, 单因素分析用Logrank检验, 将P < 0.2的各因素进入COX多因素回归分析。检验水准a=0.05。
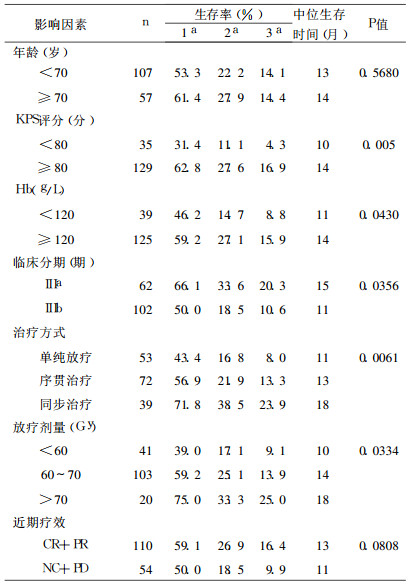
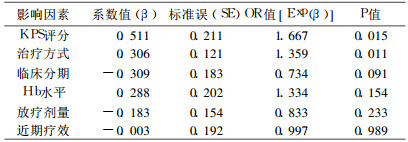
2 结果随访4 ~ 66个月, 失访9例, 随访率94.5%。存活12例, 死亡143例, 其中死于局部复发或未控制62例, 远处转移45例, 局部复发+转移24例, 其他原因12例。155例随访者的中位生存时间为13个月, 1、2、3a生存率分别为56.1%、24.2%、14.3%。影响预后的单因素分析结果见表 1, 多因素分析结果见表 2。由表 2可见, KPS评分和治疗方式是独立预后因素。单纯放疗、序贯治疗及同步治疗严重不良反应发生率分别为1.9% (1/53)、12.5%(9/72)、48.7%(19 /39), 两两比较, P均 < 0.01。
|
|
表 1 单因素分析结果 |
|
|
表 2 多因素分析结果 |
放疗是Ⅲ期NSCLC主要治疗方式, 但单纯放疗效果不佳, 5a生存率仅为5% ~ 10%[1], 放化疗结合是目前Ⅲ期NSCLC的主要治疗方法。Marino等[2]对1980 ~ 1994年14个临床试验的1 887例NSCLC行meta分析, 结果与单纯放疗相比, 放化疗联合治疗使1、2a病死率下降24%和30%。化疗与放疗联合主要有序贯和同步两种方式, Furuse等[3-5]研究证实, NSCLC患者同步治疗的中位生存期长于序贯治疗。本文结果显示, 同步治疗者的中位生存时间和1、3a生存率明显高于单纯放疗, 但毒副反应有所增加。
普通放疗剂量仅能达到60Gy左右, 此剂量对较大肿瘤达不到根治量。三维适形放疗定位准确, 可降低周围正常组织受量, 增加靶区剂量, 提高局部控制率和生存时间。Sura等[6]针对NSCLC患者利用三维适形放疗80Gy以上, 结果Ⅲ期患者的5a局部控制率和生存时间达到39%和31%, 中位生存时间32个月。笔者行三维适形放疗29例, 中位生存时间和1a生存率分别是17个月、72.4%, 而行三维适形同步治疗者9例, 中位生存时间21个月。因病例数较少, 三维适形同步治疗的疗效尚需进一步探讨。
美国胸科医师协会的Ⅲb期NSCLC临床实践指南认为[7], 对不能手术的NSCLC患者, 如果一般状况好, 体质量减少轻微, 则化放疗联合较单纯放疗效果好, 同步治疗较序贯治疗生存期延长。本研究单因素分析显示, KPS评分≥ 80分, 临床分期Ⅲa期, 放疗剂量高, 治疗前Hb≥120g/L及用综合治疗的效果较好。多因素分析示KPS评分和治疗方式为独立预后因素, 与文献报道相似[8]。我们体会, Ⅲ期NSCLC患者如果一般状况较好, 建议积极赞同中步治疗, 放疗应尽量采用三维适形以提高肿瘤剂量; 如一般状况差或年龄、肝肾功能异常, 患者不能耐受同步治疗, 则序贯治疗亦能延长生存时间。对于化放疗的结合方式(诱导化疗后同步治疗或同步治疗后巩固化疗)及适形放疗的剂量问题尚有待进一步研究。
| [1] |
Baumann M, Appokls, Petersen C, et al. Dose and fractionation concepts in the prmary radiotherapy of non-small cell lung Cancer[J]. Lung cancer, 2001, 33(suppll): s35-45. |
| [2] |
Marino P, Preatoni A, Cantoni A. Randamized trials of rad iotherapy alone versus cambined chemotherapy and radiotherapy in stages Ⅲa and Ⅲb non-small cell lung cancer a meta-analyses[J]. Cancer, 1995, 76(4): 593-601. |
| [3] |
Furuse K, Fukuoka M, Kawahara M, et al. Phase Ⅲ study of con-Current versus sequential thoracic radiotherapy in combination with mitaycin, Vindesine, and cisplatin in unrexctable stage Ⅲ nonsmall-cell lung cancer[J]. J Clin col, 1999, 17(9): 2692-2699. DOI:10.1200/JCO.1999.17.9.2692 |
| [4] |
Zatloukal P, Petruzelkal, Zemanovam, et al. Orad iotherapy with cisplatin and vinorelbine in locally advanced nonsmall cell lung cancer arandomized study[J]. Lung cancer, 2004, 46(1): 87-98. DOI:10.1016/j.lungcan.2004.03.004 |
| [5] |
Foumelp, Robinet G, Thamsas P, et al. Randamized phase Ⅲ trial of sequential chem.Orad io therapy campared with concurrent chemora-diotherapy in locally advanced non-small cell lung cancer[J]. J Clin Oncol, 2005, 23(25): 5859-5861. DOI:10.1200/JCO.2005.05.035 |
| [6] |
Sura S, Yorke E, Jackson A, et al. High-dose radiotherapy for the treatment of inoperab le non-small cell lung cancer[J]. Cancer J, 2007, 13(4): 238-242. DOI:10.1097/PPO.0b013e31813ffd7b |
| [7] |
Jett JR, Schikl SE, Keith RL, et al. Trealment of non-small cell lung cancer stage ⅢB:ACCP evidence-based clinical practice guidelines(2nd edition)[J]. Chest, 2007, 132(3 suppl): 266S-277S. |
| [8] |
de CosEscuin JS, Delgado IU, Rodriguez JC, et al. Stage ⅢA and ⅢB non-small cell lung cancer results of chem.Otherapy combined with radiation therapy and analysis of prognostic factors[J]. Arch Bronconeumol, 2007, 43(7): 358-365. DOI:10.1157/13107691 |