放疗是临床上治疗恶性肿瘤的重要手段之一, 在放疗过程中患者易导致白细胞减少和机体抵抗力降低, 进而影响放疗疗效。利用天然植物中的有效活性成分, 增强机体免疫力, 防止或减轻辐射对人体的损伤, 是提高肿瘤治疗疗效的重要途径之一, 在辐射防护中显示出越来越重要的地位。多糖是天然植物中的主要活性成分之一, 具有抗感染、抗肿瘤、抗病毒、增强免疫等多方面的生理功能[1]。本试验以小鼠为试验对象, 研究灰树花多糖的免疫调节和辐射防护作用。
1 材料和方法 1.1 受试物由山东某药业公司提供。
1.2 实验动物SPF级ICR小鼠, 雌性, 体重18~22g, 由北京维通利华实验动物技术有限公司提供, 许可证号为SCXK(京) 2007-0001。饲养环境为屏障级动物室。
1.3 主要仪器与试剂洁净工作台、CO2培养箱、Spectramax PLUS型酶标仪、电子天平、显微镜、数显游标卡尺(精密度0.01 mm)等; SRBC、鸡红细胞、YAC-1细胞、补体(豚鼠血清)、Hanks液、SA缓冲液、Tris-HCl缓冲液、LDH基质液、PBS缓冲液、Giemsa染液、RPMI1640细胞培养液、琼脂糖、印度墨汁、都氏试剂、1%NP40、ConA、MTT、SOD试剂盒(南京建成生物工程研究所)。
1.4 实验方法[2] 1.4.1 动物分组与剂量选择取192只小鼠按体重随机分为4个大组, 每个大组48只, 内设3个剂量组(0.15g/kg、0.30g/ kg、0.90g/kg)和1个溶剂对照组。经口灌胃给予受试物, 溶剂对照组给予同体积蒸馏水, 每日1次, 连续30d后进行小鼠免疫功能指标测定。另取144只小鼠, 按体重随机分为3个大组, 每个大组48只, 内设3个剂量组和1个辐照模型对照组。剂量设计和给药方式同上, 进行抗辐射指标检测。
1.4.2 细胞免疫功能指标检测① 迟发型变态反应(DTH):小鼠腹腔注射2%(V/V)SRBC, 致敏后4d测量左后足跖厚度, 然后在测量部位皮下注射20%(V/V)SRBC, 注射后24h测量左后足跖部厚度, 同一部位测量三次, 取均值。以攻击前后足跖厚度差值(足跖肿胀度)来表示DTH的程度。②ConA诱导的小鼠脾淋巴细胞增殖能力(MTT法):无菌取脾, 制成3×106个/ml脾细胞悬液, 分两孔加入24孔培养板中, 每孔1ml, 一孔加入75μl ConA液, 另一孔作为对照, 置5%CO2、37℃培养箱中培养72h。培养结束前4h, 每孔吸取上清液0.7ml, 加入0.7ml不含小牛血清的RPMI1640完全培养液, 同时加入MTT50μl, 继续培养4h。培养结束后, 每孔加入1ml酸性异丙醇, 吹打均匀使紫色结晶完全溶解, 在570nm波长处测定OD值, 以加ConA孔的OD值减去不加ConA孔的OD值表示淋巴细胞增殖能力。
1.4.3 体液免疫功能指标检测① 血清溶血素测定:小鼠腹腔注射SRBC免疫5d后, 取血清用SA缓冲液稀释200倍。将稀释后的血清1mL置试管内, 依次加入10%(V/V)SRBC0.5mL、补体1mL(用SA液按1:8稀释)。另设不加血清的对照管(以SA液代替)。置37℃恒温水浴中保温20min后冰浴终止反应, 离心取上清液1mL, 加都氏试剂3mL, 同时取10%(V/V) SRBC 0.25mL加都氏试剂至4mL, 充分混匀, 放置10min后, 于540nm处测定光密度值。计算半数溶血值(HC50)。②抗体生成细胞检测:SRBC免疫5d后, 取脾制成细胞悬液。将表层培养基加热溶解后与等量双倍Hanks液混合, 分装小试管, 每管0.5ml, 再向管内加50μl 10%SRBC(V/V, 用SA液配制)、20μl脾细胞悬液, 迅速混匀后, 倾倒于已刷琼脂糖薄层的玻片上, 待琼脂凝固后, 将玻片水平扣放在玻片架上, 放入CO2培养箱温育1.5h, 然后用SA液稀释的补体(1:8)加入到玻片架凹槽内, 继续温育1.5h后, 计数溶血空斑数。
1.4.4 单核-巨噬细胞功能指标检测① 小鼠碳廓清指数:小鼠尾静脉注射1:3稀释的印度墨汁, 待墨汁注入立即计时, 注入墨汁后2、10min, 分别从内眦静脉丛取血20μl, 并将其加到2ml Na2CO3溶液中, 用紫外可见分光光度计在600nm波长处测光密度值。将小鼠处死, 取肝和脾脏称重, 计算廓清指数。②小鼠腹腔巨噬细胞吞噬指数:小鼠腹腔注射20%鸡红细胞悬液1ml, 间隔30min处死, 固定于鼠板上, 剪开腹壁皮肤, 注射生理盐水2ml, 转动鼠板1min, 吸出腹腔洗液1ml, 分滴于2片玻片上, 37℃温育30min, 用生理盐水漂洗, 晾干, 以1:1丙酮甲醇溶液固定, Giemsa染液染色10min, 漂洗晾干, 镜检, 计算吞噬率和吞噬指数。
1.4.5 NK细胞活性测定实验前24h将YAC-1细胞(靶细胞)传代培养, 用RPMI1640完全培养液调整细胞浓度为4× 105个/ml。无菌取脾, 制备脾细胞悬液, 用Hanks液洗2次, 弃上清, 沉淀中加入3ml NH4Cl裂解液裂解红细胞, 10min后再加入7ml Hanks液, 离心10min(1000r/min), 用RPMI1640完全培养液调整细胞浓度为2×107个/ml。取靶细胞和脾细胞各100μl(效靶比50:1), 加入96孔培养板中, 靶细胞自然释放孔加靶细胞和培养液各100μl, 靶细胞最大释放孔加靶细胞和1% NP40各100μl, 于37℃、5%CO2培养箱中培养4h, 离心, 取上清100μl置96孔酶标板中, 加入LDH基质液100μl, 反应6min, 以1mol/L的HCl终止反应, 在酶标仪490nm处测光密度值, 计算NK细胞活性。
1.4.6 抗辐射能力指标检测① 外周血白细胞计数:取小鼠尾血计数白细胞总数, 并依此为指标随机分为辐照模型对照组和三个剂量组, 在实验的第30天各组均以4Gy60Co-γ射线照射一次, 剂量率为0.25Gy/min, 照射后第3、14天作白细胞计数。②小鼠骨髓细胞DNA含量检测:剂量组和辐照模型对照组小鼠均以4Gy60Co-γ射线照射一次, 剂量率为0.25Gy/min, 照射后第3天处死小鼠, 取股骨, 用注射器吸取4ml Hanks液, 冲出股骨中的全部骨髓细胞, 在260nm处测定光密度值(OD)。③血清超氧化物歧化酶(SOD)活力检测:剂量组和辐照模型对照组小鼠均以6Gy60Co-γ射线照射一次, 剂量率为0.25Gy/ min, 于照射后第7天摘眼球采血, 离心, 取血清, 按试剂盒说明书测定血清超氧化物歧化酶(SOD)活力。
1.5 统计分析采用SPSS软件进行统计学处理和方差分析。
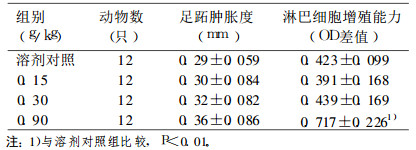
2 结果 2.1 灰树花多糖对小鼠细胞免疫功能的影响见表 1。
|
|
表 1 灰树花多糖对小鼠足跖肿胀度及淋巴细胞增殖能力的影响 |
见表 2。
|
|
表 2 灰树花多糖对小鼠抗体生成细胞及溶血素的影响 |
见表 3。
|
|
表 3 灰树花多糖对小鼠单核-巨噬细胞功能的影响 |
见表 4。
|
|
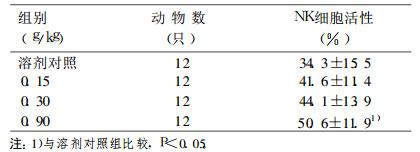
表 4 灰树花多糖对小鼠NK细胞活性的影响 |
见表 5。
|
|
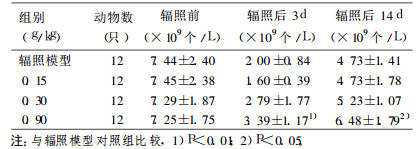
表 5 灰树花多糖对小鼠辐照前后外周血白细胞计数的影响 |
由表 5可见, 辐照前各组小鼠白细胞总数无显著性差异(P>0.05), 辐照后第3天辐照模型对照组白细胞总数与辐照前相比, 明显降低(P < 0.01), 表明辐照模型成立。辐照后第3天、第14天0.90g/kg组小鼠白细胞总数与模型对照组比较差异均有统计学意义(P < 0.01或P < 0.05)。
2.6 灰树花多糖对小鼠骨髓细胞DNA含量和血清超氧化物歧化酶(SOD)活力的影响|
|
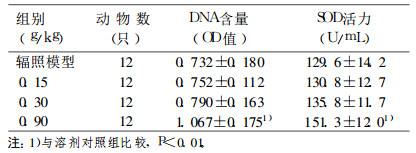
表 6 灰树花多糖对小鼠骨髓细胞DNA含量和血清SOD活力的影响 |
电离辐射作用于人体后, 可直接作用于DNA、蛋白及酶类, 引起电离和化学键断裂, 使分子变性和细胞结构破坏; 也可作用于机体内水分子使其发生电离和激发, 产生大量的具有强氧化性能的自由基, 而间接使组织细胞变性、坏死、致使代谢紊乱, 引起免疫、神经和内分泌系统的调节功能障碍[3]。
造血组织是辐射高度敏感的组织, 造血功能障碍是辐射损伤的主要表现之一。本研究表明, 小鼠接受4Gy60Co-γ射线一次性全身照射后, 辐照模型对照组小鼠外周血WBC计数严重降低, 骨髓细胞DNA含量下降, 呈现出明显的辐射损伤效应。而灰树花多糖高剂量组动物外周血WBC总数、骨髓细胞DNA含量和血清超氧化物歧化酶(SOD)活力明显高于辐照模型对照组, 表明灰树花多糖具有一定的辐射损伤保护作用。
近年来研究的中药防治辐射损伤的机理主要是:①多糖成分通过增加骨髓祖细胞和骨髓有核细胞数量, 抑制造血细胞凋亡, 促进骨髓基质细胞分泌基质改善造血微环境, 来预防和治疗辐射导致的造血功能障碍[4]; ②多糖类物质是一种天然的非特异性免疫增强剂, 通过作用于网状内皮系统、巨噬细胞、淋巴细胞、白细胞参与调节蛋白质的合成、抗体的生成、补体的生成以及对各种细胞因子表达功能, 增强机体免疫力[5]; ③通过抗氧化作用, 加大清除自由基的能力, 发挥辐射保护效应[6, 7]。本研究中的6项免疫指标和抗氧化酶(SOD)活力的显著增强也提示:灰树花多糖可能通过提高机体的免疫功能和抗氧化能力而起到辐射保护作用。
| [1] |
李德远, 汤坚, 刘建峰, 等. 枸杞抗辐射效应研究[J]. 食品科学, 2003, 24(3): 131-135. DOI:10.3321/j.issn:1002-6630.2003.03.036 |
| [2] |
卫生部.保健食品检验与评价技术规范[S]. 2003-02-14.
|
| [3] |
张春生, 彭珊茁. 抗氧化物质在辐射防护中的作用[J]. 中国工业医学杂志, 2003, 16: 222-224. DOI:10.3969/j.issn.1002-221X.2003.04.014 |
| [4] |
席亚明, 席亚荣, 孙延庆, 等. 梁金菇多糖对辐射损伤小鼠造血功能的影响[J]. 中华放射医学与防护杂志, 2002, 22: 291-293. DOI:10.3760/cma.j.issn.0254-5098.2002.04.021 |
| [5] |
季修庆, 吴士良. 中药多糖辐射防护分子机制[J]. 江苏大学学报, 2004, 14(1): 83-84. DOI:10.3969/j.issn.1671-6604.2004.01.016 |
| [6] |
葛明珠, 张勇, 任少林. 南沙参多糖的辐射防护作用[J]. 中华放射医学与防护杂志, 1996, 16(2): 123-125. |
| [7] |
苗明三. 怀山药多糖抗氧化作研究[J]. 中国医药学报, 1997, 12(2): 22-23. DOI:10.3321/j.issn:1673-1727.1997.02.008 |