2. 吉林大学公共卫生学院 卫生部放射生物学重点实验室, 吉林 长春 130021
低剂量电离辐射能够诱导生精细胞凋亡, 并具有明显的细胞种类选择性[1]。线粒体细胞凋亡中起着中心调控作用。当凋亡发生时, 水的辐解产物包括一氧化氮(NO)在内的多种活性氧类物质增多[2], 造成其膜电位降低, 线粒体发生肿胀, 包括凋亡诱导因子(apoptosis inducing factor, AIF)在内的多种线粒体膜间蛋白释放到细胞质中, 继而激活下游因子, 导致凋亡的发生。AIF是一类存在于线粒体内外膜间隙的保守黄素蛋白, 可独立与caspases途径外引起细胞染色体的凝聚和DNA大的片段化, 诱导细胞凋亡的发生[3]。本实验旨在研究低剂量X射线照射诱导NO含量、NOS活性及AIF的变化规律, 并探讨其与生精细胞凋亡之间的关系。
1 材料与方法 1.1 实验动物采用健康雄性昆明小鼠, 体重(20±2)g, 由吉林大学基础医学院实验动物中心提供, 动物证号:SXCK (吉)203-00007, 随机分成对照组和照射组, 每组实验动物5只。
1.2 分组与照射实验分为剂量组(0、0.025、0.05、0.075、0.1和0.2Gy)和时程组(0、3、6、12、18和24h), 应用国产深部X.S.S.250(FZ)型固定式X射线深部治疗机全身照射小鼠, 电压200kV, 电流10mA, 滤板0.5mmCu+1.0mmAl。靶皮距212cm, 吸收剂量率0.0125Gy/min。
1.3 NO含量及NOS活性的检测实验小鼠经过0.025~0.2GyX射线照射后, 颈部脱臼处死, 两侧睾丸冻存在液氮中。睾丸组织制成10%组织匀浆, 用低温低速离心机3000r/min离心10~15min, 吸取上清, 用考马斯亮蓝蛋白测定试剂盒检测各组蛋白浓度。各取100μl上清, 利用NO及NOS试剂盒(南京建成生物公司), 紫外分光光度仪于550nm和530nm处检测吸光度A值, 按照公式计算NO含量及NOS活性。
1.4 Real-time PCR检测AIF mRNA表达取出液氮冻存的小鼠睾丸, 以TRI zol(上海生工)提取总RNA、定量、逆转录。反应条件:42℃反应15min(逆转录反应), 95℃反应2min(逆转录酶的失活反应)。应用Mx3000P real time PCR(Stratagene公司, 日本)扩增仪进行PCR扩增, 条件为95℃、10s预变性, 然后按照95℃、5s, 60℃、20s, 共40循环。AIF引物(大连宝生物), F:5′-CCA ATA GCT TCA TAG CCG ACA TCA-3′, R:5′ -GGT CGA AGG CGA GTA GAG CAT C-3′; GAPDH引物(大连宝生物), F:5′-AAA TGG TGA AGG TCG GTG TG-3′, R: 5′-TGA AGG GGT CGT TGA TGG-3′。本实验采用相对标准曲线进行结果分析, 利用未知浓度的样品等比稀释后, 进行real time PCR, 获得Ct值, 继而得到的相对标准曲线[4, 5]。将目的基因样品与内参照基因GAPDH分别进行real time PCR, 得到的Ct值, 代入相对标准曲线, 将得到的值进行比较, 即可进行定量, 即目的基因mRNA表达=目的基因量/GAPDH基因量[6]。
1.5 Western blot检测AIF蛋白的表达取出液氮冻存的小鼠睾丸, 提取总蛋白、考马斯亮蓝法进行蛋白定量。等量蛋白上样, 微型电泳槽(Bio-Rad, 美国)进行电泳, 浓缩胶采用60V恒压, 分离胶采用90V恒压, 直到颜料泳到胶的前沿为止。4℃, 恒流200mA条件转40min至硝酸纤维素膜(BioRad, 美国), 转好的膜经过丽春红染色确定转移的效率及蛋白Marker的位置。硝酸纤维素膜经新鲜配置的封闭液(1×TBS, 5%脱脂奶粉, 0.05%Tween-20)4℃封闭过夜, 分别与AIF兔抗鼠IgG多抗和GAPDH山羊抗鼠IgG多抗(1:500, Santa Cruz)、辣根酶标记的抗山羊和抗兔IgG二抗(1:2000, 北京中杉生物公司)进行反应, 清洗, 最后进行ECL试剂发光, X光片曝光显影。
1.6 统计学处理实验结果以x±s表示, 应用SPSS12.0软件包t检验进行统计分析。
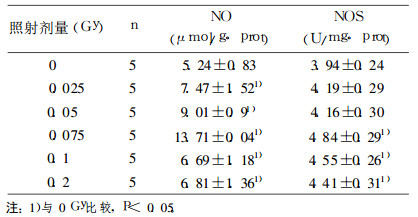
2 结果 2.1 0~0.2GyX射线照射后12hNO含量及NOS活性的变化0~0.2GyX射线全身照射后12h, 小鼠睾丸组织中NO含量及NOS活性随照射剂量增加而增加, 0.075Gy增至最大(P < 0.05, 表 1), 0.1~0.2Gy一直维持在较高较高水平(P < 0.05, 表 1)。
|
|
表 1 0.025~0.2GyX射线照射后12h睾丸组织中NO含量和NOS活性的变化 |
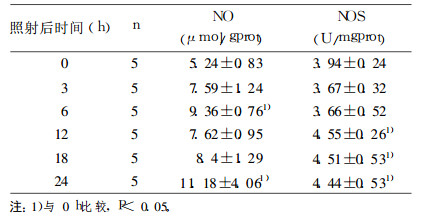
0.075GyX射线照射后, 组织中NO含量在6h陡增外, 一般随着时间延长而逐渐增高, 在24h升高到峰值并维持在高水平(P < 0.05, 表 2); NOS活性在3与6h稍有降低, 其后随时间延长则增高, 12h增至峰值并维持高水平(P < 0.05, 表 2)。
|
|
表 2 0.075GyX射线照射后0~24h小鼠睾丸组织中NO含量及NOS活性的变化 |
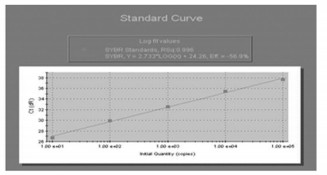
本实验采用real-time RT-PCR法检测相关基因mRNA水平的表达, 根据Ct值, 经过对数拟合做图, 得到相对标准曲线(图 1), 回归方程为Y=2.733×Log(X)+24.26, 相关系数(correlation)R=0.986, 其线性范围从100~105, 起始模板的浓度与Ct值之间呈现良好的线性关系, 结果准确可靠。
|
图 1 GAPDH标准模板的实时PCR标准曲线 |
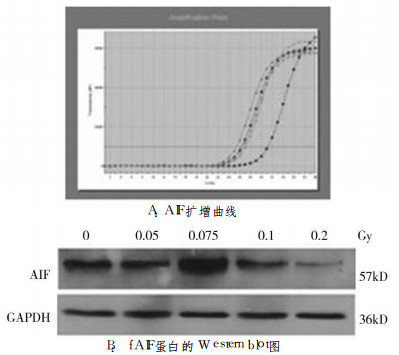
AIF mRNA表达随着剂量的增加而增加, AIF/GAPDH在0 ~0.2Gy照射分别为1.56±0.01、2.11±0.01、2.29±0.02、7.74±0.01和7.26±0.01。在0.1Gy时达到最大; 0.1、0.2 Gy与0Gy比较, 差异有统计学意义(P < 0.01, 图 2-A)。GAPDH蛋白表达基本一致, 而AIF蛋白表达则在0.75Gy时最大, 0.1与0.2Gy表达降低(图 2-B)。
|
图 2 0~0.2Gy照射后12hAIF mRNA和蛋白的表达 |
AIF/GAPDH在0~24h分别为1.80 ±0.01、1.14±0.0、2.34±0.01和9.71±0.01, 其中24h较0h增加明显(P < 0.01, 图 3-A)。GAPDH蛋白表达基本一致, 而AIF表达12h表达最大, 而后下降(图 3-B)。
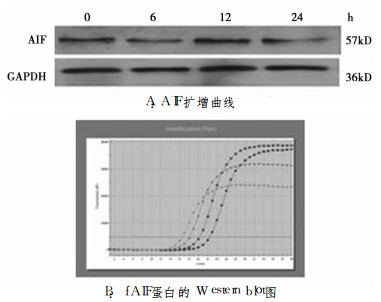
|
图 3 0.075Gy照射后不同时间AIF mRNA和蛋白的表达 |
凋亡是一种由基因调控的细胞程序性死亡, 在凋亡发生过程中, 凋亡细胞不仅发生了生化变化, 而且具有凋亡的特征性细胞形态和超微结构。刘光伟等[1]报道, 低剂量电离辐射可诱导小鼠睾丸生精细胞凋亡, 并且具有明显的细胞种类选择性。NO是一种具有生物活性的自由基, 在哺乳动物的生殖系统中广泛存在, 不仅可以诱导生殖细胞凋亡, 还对生殖细胞的发生、成熟起重要作用[7, 8]。NO诱导细胞凋亡主要是通过氧化应激, 影响线粒体和能量代谢及直接使DNA损伤及突变。NO轨道上有一个不成对电子, 反应活泼性极强, 与氧作用生成大量活性氧中间产物(reactive oxygenin termediates, ROI), 这些ROI易与细胞膜上的多不饱和脂肪酸及胆固醇反应产生过氧化脂质, 破坏线粒体的结构完整性、能诱导线粒体膜通道的开放, 使线粒体去极化和肿胀, 释放包括大量凋亡诱导蛋白的线粒体内容物。NO作用于线粒体是其促进细胞死亡的主要方面。扩散进入线粒体的及自身合成的NO参与能量代谢, 既能通过各种途径降低ATP生成, 又能促进ATP消耗, 导致线粒体调解细胞能量代谢紊乱。NO引起的DNA损伤及突变是NO诱导细胞凋亡的一个更直接的因子。另外, NO引起ATP消耗, 抑制内质网和质膜Ca2+-ATP酶, 使胞内Ca2+平衡失调, 继而导致细胞的凋亡。NOS(oxide synthase)是NO合成的关键酶, 包括神经型NOS(neuronalnitric oxide synthase, nNOS)、诱生型NOS(induc- ible nitric oxide synthase, iNOS)和内皮型NOS(endothelial NOS, eNOS)。本实验采用生物酶法检测0.025~0.2GyX射线照射后12h及0.075GyX射线照射后0~24h, 小鼠睾丸组织中NO含量及NOS活性的变化, 旨在探讨NO含量及NOS活性变化对线粒体调控低剂量电离辐射诱导小鼠睾丸生精细胞凋亡中的作用。
凋亡诱导因子(apoptosis inducing factors, AIF)是近年来发现的一种凋亡效应分子[9]。当由凋亡信号刺激时, AIF分子从线粒体释放到细胞浆, 再通过其核定位信号转位到细胞核中, AIF可通过其DNA结合区直接作用于核DNA, 和另外一个线粒体蛋白endonuclease G(Endo G)一起, 导致DNA片断化(平均50kb)[10], 直接引起导致细胞凋亡; 或者与caspase及Cyt-c协同引起细胞的凋亡[11, 12]。以real time PCR和Western blot法检测相同实验条件下, 小鼠睾丸组织中AIF mRNA及蛋白表达的变化, 为证明NO作用于线粒体, 导致线粒体内容物释放, 继而诱导凋亡的发生提供实验证据。结果显示, 0~0.2GyX射线照射后12h, NO含量及NOS活性都随着剂量增加而增加, 0.075Gy照射后增加最明显(P < 0.05);AIF mRNA表达在0.1 Gy照射表达最大, 而蛋白表达在0.075Gy表达最大, 这与前期结果一致[13]。0.075GyX射线照射后0~24h, NO含量及NOS活性基本上随着时间延长而增加, NO含量在24h时达到峰值(P < 0.05), 而NOS活性在12h时达到峰值(P < 0.05); AIF mRNA在24h时达到峰值, 而蛋白则在12h达到最大。这些结果暗示, 低剂量电离辐射能够诱导NO含量及NOS活性产生, 引起线粒体结构和功能变化, 释放AIF, 既而诱发凋亡, 而且具有时程和量效规律性。这为NO、NOS及AIF调控电离辐射诱导生精细胞凋亡提供了重要的实验依据。
| [1] |
Liu Guangwei, Gong Pingsheng, Zhao Hongguang, et al. Effects of low-level Radiaton on the Death of Male Germ cells[J]. Radiat Res, 2006, 165: 379-389. DOI:10.1667/RR3528.1 |
| [2] |
王志成, 李艳博, 郭伟, 等. 低剂量电离辐射对小鼠睾丸生精细胞中活性氧和线粒体膜电位的影响[J]. 吉林大学学报(医学版), 2007, 33(5): 786-789. |
| [3] |
Cande C, Cecconi F, Dessen P, et al. Apoptosis-inducing factor (AIF):Key to the conserved caspase-independent pathways of cell death[J]. J Cell Sci, 2002, 115(24): 4727-4734. DOI:10.1242/jcs.00210 |
| [4] |
Wang Yaming, Zhu Wei, David EL. Nuclear and cytoplasmic mRNA quantification by SYBR green based real-time RTPCR[J]. Methods, 2006, 39(4): 356-362. DOI:10.1016/j.ymeth.2006.06.010 |
| [5] |
Heather SW, Florian MG, David JI, et al. Analysis of multi-ple exon-skipping mRNA splice variants using SYBR Green real-time RT-PCR[J]. Journal of Neuroscience Methods, 2007, 160(2): 294-301. DOI:10.1016/j.jneumeth.2006.09.022 |
| [6] |
Morsczeck C, Korenkov M, Nagelschmidt M, et al. Total RNA-Isolation of Abdominal Hernia of Rats for Quantitative Real-Time Reverse Transcription (RT) PCR Assays[J]. Prep Biochem Biotech, 2008, 38(1): 87-93. |
| [7] |
杨阳, 杨劢贵, 张晓东. 一氧化氮对人体病理及生理的研究进展[J]. 中华临床医学, 2004, 5(22): 25-27. |
| [8] |
Francavilla F, Santucci R, Macerola B, et al. Nitric oxide synthase inhibition in human sperm affects sperm-oocyte fusion but not zona pellucida binding[J]. Biol Reprod, 2000, 63(2): 425-429. DOI:10.1095/biolreprod63.2.425 |
| [9] |
Susin SA, Lorenao HK, Zamzami N, et al. Molecular charac-terization of mitochondrial apoptosis inducing factor[J]. Na-ture, 1999, 397(6718): 441-446. |
| [10] |
Cande C, Cecconi F, Dessen P, et al. Apoptosis-inducing factor (AIF):Key to the conserved caspase-independent pathways of cell death[J]. J Cell Sc, 2002, 115(24): 4727-4734. DOI:10.1242/jcs.00210 |
| [11] |
Van GM, Festjens N, Van LG, et al. Mitochondrial inter-membrane proteins in cell death[J]. BBRC, 2003, 304(3): 487-497. |
| [12] |
Tsujimoto Y. Cell death regulation by the Bcl-2 protein family in the mitochondria[J]. J Cell Phy, 2003, 195(2): 158-167. DOI:10.1002/(ISSN)1097-4652 |
| [13] |
王志成, 李艳博, 龚平生, 等. 低剂量X射线对小鼠睾丸生精细胞中凋亡诱导因子变化的影响[J]. 辐射研究与辐射工艺学报, 2008, 26(1): 28-32. DOI:10.3969/j.issn.1000-3436.2008.01.007 |