H2AX是组蛋白H2A的一种变体, H2AX能在丝氨酸1上被磷酸化, 在赖氨酸5上被乙酰化, 在赖氨酸119上被泛酸化。但是真正使H2AX独特的部位是位于离C端4个氨基酸处的一个高度保守的丝氨酸残基[1]。作为DNA断裂的信号分子, H2AX在DSBs出现后迅速被磷酸化为γ-H2AX。γ-H2AX在DNA修复, 细胞周期调控, 基因重组事件和肿瘤抑制方面具有重要的作用[2], 抗γ-H2AX抗体的增强的过程产生了核内焦点[3]。诱导的DSBs的位置可由γ-H2AX荧光点探测出来, 这些荧光点和细胞图像上的蚀刻槽是一致的[4]。γ-H2AX可以探测由重离子诱导的DSBs效应。
最近相继有报道表明, 电离辐射后检测到的γ-H2AX蛋白活化荧光灶数量与辐射剂量存在依赖关系。电离辐射引起的DNA双链断裂均伴随H2AX的磷酸化和簇集, 且γ-H2AX核灶形成没有细胞特异性。鉴此, 作为一种具有潜在意义的新生物剂量指标, 活化H2AX的观察已列入美国2005年启动的, 大规模人群受照剂量快速筛查的生物剂量检测方法和技术的研究计划中。根据观察到的γ-H2AX荧光灶数量来估算生物受照物理剂量, 是业内人士期待的方法。从目前发表的文章来看, 这类研究观察的剂量范围多数在0.25~2Gy, 少量低值为0.05Gy, 中值为4~6Gy, 高值超过10Gy[5-7]。
本研究用共聚焦显微镜检测γ-H2AX生成的焦点数与剂量的关系, 生成的图像用Ipp6.0处理获得焦点个数、大小、密度的数据。
1 材料与方法 1.1 试剂一抗:鼠抗人γ-H2AX(JBW301), Upstate Biotechnology(NY, USA)生产; 二抗:FITC标记羊抗鼠IgG(ZF0312), 北京中杉金桥生物技术有限公司生产; 抗体稀释剂和羊血清封闭剂均为武汉博士德生物工程有限公司生产; DAPI, Molecularprobes, USA生产; Wister雌性大鼠为本所动物室提供, 体重在240~260g范围内。
1.2 仪器137Csγ射线照射容器(Gamma cell40, Atomicenergy of Canada Ltd.), 剂量率1.24Gy/min; 激光扫描共聚焦显微镜(TCSSPE), 德国Leica; 台式高速冷冻离心机(TL-18M), 上海离心机械研究所; 台式离心机(Anke TL-D 40B), 上海安亭科学仪器厂; 电子天平(ALC1100.2), 北京赛多里斯仪器系统有限公司; 微量加样器, 德国Eppendof, 法国Gilson。
1.3 照射将21只雌性Wister大鼠分成7组, 每组3只, 分7个剂量点照射(0、0.5、1、2、4、6、8 Gy)。每只大鼠照射前10min, 取眼内眦静脉血1ml, 作为离体血样, 将离体血液与大鼠同时照射。大鼠照射后再次取眼内眦静脉血1ml作为整体照射血样。
1.4 制片取照射后的血样0.5ml, 加0.5ml的PBS混匀。取1ml淋巴细胞分离液置于离心管中, 缓缓加入稀释后的血样1ml于分离液上面, 在低速离心机上1 450rpm离心20min。吸取淋巴细胞层于EP管中, 加适量PBS至刻度, 1 800rpm离心10min洗2次。显微镜下计数, 浓度达到1×106/ml为宜。甩片(每片所加细胞悬液的细胞数达到2×105/ml), 用2%甲醛洗涤3min, PBS洗3次后, 用Triton PSB通透10min, 3次, PBS洗后用山羊血清封闭37℃30min。一抗和二抗孵育(用锡纸包裹避光)后, DAPI染色, 最后用封固剂封片待测。
1.5 样品观察及图像分析用激光扫描共聚焦显微镜检测样品片, 均放大1 000倍(×100油物镜), 使用相同的参数检测各组样品(如:pinhole, AOTF), 每个样品最少拍取40个细胞, 6~7个视野。用图像处理软件IPP 6.0对采得的图像进行分析, 分析的指标有以下三个:焦点个数number, DAPI面积area, 焦点校正密度Cor.density。
用SAS软件分别检验离体和整体条件下的剂量效应的关系, 及离体照射与整体照射的效应关系的一致性。
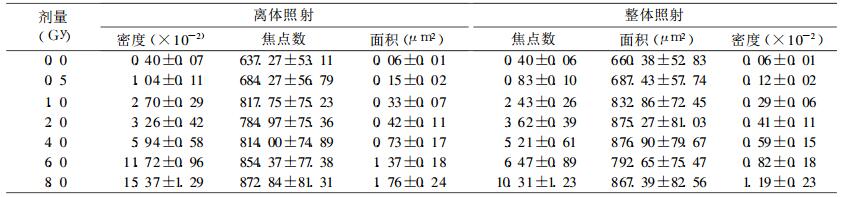
2 结果 2.1 不同剂量点下γ-H2AX焦点荧光照片(图 1)
|
图 1 不同剂量照射γ-H2AX焦点荧光照片 |
|
|
表 1 不同照射剂量的焦点数量、面积和校正焦点密度值 |
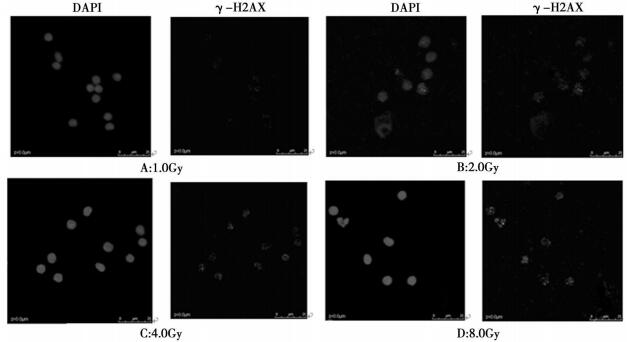
用SAS软件检验在整体和离体情况下各自的剂量效应关系。剂量dose, 焦点个数number, 面积area, 焦点密度density。Dose(x)与density(y)的线性相关系数R=0.9925, 决定系数R2=0.9851, 方差分析的P值< 0.0001, dose的系数>0, 说明, 随着剂量的增大, 细胞的焦点密度会增大, 即细胞受到的损伤增大。离体照射条件下剂量与焦点密度的回归曲线方程为Y离=0.040 +0.21X。

|
图 2 离体条件下γ-H2AX焦点密度与照射剂量的关系 |
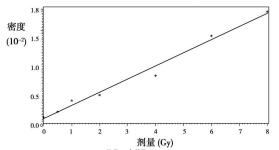
整体条件下dose(x)与density(y)的线性相关系数是0.9902, 决定系数是0.9805, 方差分析的P值< 0.0001, dose的系数>0, 说明, 随着剂量的增大, 细胞的焦点密度会增大, 即细胞受到的损伤增大。整体条件下剂量效应曲线, 回归方程为:y=0.096 +0.13x.
|
图 3 整体条件下γ-H2AX焦点密度与照射剂量的关系 |
用SAS对整体和离体两种条件下的效应做一致性检验, R=0.984, 说明整体照射和离体照射的的结果有很好的相关性, 离体实验可以替代整体实验说明剂量效应关系。
3 讨论分析目前测定H2AX与辐射剂量效应关系的方法除了流式细胞仪和west blotting之外, 还有免疫荧光检测方法[8], 本研究就是用共聚焦显微镜检测免疫荧光的方法研究H2AX的剂量效应关系。在物理或化学试剂的作用下, 不同的细胞参数可能会展示不同的剂量效应曲线。比如说, 多种细胞在1~2 000mGy的x射线范围内照射后, DSBs与辐射剂量就有很明显的线性关系[3, 9, 10]。外周血样品中淋巴细胞中的γ-H2AX的平均数量与整体照射剂量有很强的线性关系(r=0.83, P < 0.0001)[11]。另外Rothkamm and Lobrich [12](2003)报道, 诱导的γ-H2AX焦点数(剂量低至1mGy)和由PFGE检测出的辐射诱导的DSB的数量有一致的趋势, 用低LET如γ射线或高LET如α射线研究辐射诱导的DSBs, 焦点的量化用软件Quantity Onesoftware。
荧光显微镜检测γ-H2AX方法的定量指标是细胞内焦点数目、γ-H2AX焦点荧光强度, 还可对γ-H2AX焦点的细胞内分布和与其他生物大分子共定位的分析。荧光显微镜检测虽然在操作上较流式耗时, 但是, 该检测方法更适用于样品不易获得、细胞量较少的情况, 如:临床活检组织, 这对于将γ-H2AX分析用于检测临床的少量、多样化标本的放射敏感性十分重要。我们使用共聚焦显微镜检测不同剂量下γ-H2AX水平, 以求从γ-H2AX焦点的角度分析γ-H2AX的剂量反应关系。
本研究中, γ-H2AX剂量反应数据拟合直线的确定系数虽然可达0.9851(0.9805), 但是加拿大Peggy L.Olive研究小组[13]对γ-H2AX剂量反应数据(0~8Gy)拟合的直线确定系数高达0.99。对此可能有两种解释。
(1)γ-H2AX剂量反应曲线的形式(斜率)是细胞依赖性的。本研究用于检测剂量反应的细胞系是Wister大鼠外周血细胞, 与Peggy L.Olive研究小组使用的不同。不同的细胞, 剂量反应曲线的形式(斜率)不尽相同, 大多数细胞是直线的, 但有的细胞是其他形式[10]。
(2)γ-H2AX剂量反应曲线的形式是时间依赖性的。对于同一细胞系, 在不同时间点的测定数据拟合直线的确定系数不同, 可能存在一个最好的时间点测定数据拟合直线最适合; 当然, 由于剂量反应实验的测定时间点为照射后40~60min内固定, 正处于γ-H2AX急剧变化时期[14]。上述差异也许是实验中各组之间的固定时间不完全相同造成的, 在后续的研究中需要进一步按照严格的时间进行固定以验证该结论。
整体和离体的一致性检验表明, 用模型动物(Wister大鼠)的外周血淋巴细胞做的细胞损伤与辐射剂量关系的实验, 有可能应用到临床, 对突发性的急性辐射病人的剂量重建与判断具有重要的意义。由于很多受病人照射之后并没能及时的进行诊察救治, 时间效应将是我们下一步研究的一个重点。
| [1] |
于琳. 基因组的监视器:组蛋白H2AX[J]. 中国肿瘤生物治疗杂志, 2006, 13(2): 156-158. DOI:10.3872/j.issn.1007-385X.2006.02.020 |
| [2] |
Oscar Fernandez-Capetillo, Alicia Lee, Michel Nussenzweig, et al. H2AX:the histone guardian of the genome[J]. DNA Repair, 2004, 3: 959-967. DOI:10.1016/j.dnarep.2004.03.024 |
| [3] |
Duane RPilch, Olga A Sedelnikova, Christophe Redon, et al. Characteristics of gamma-H2AX fociat DNA double-strand breaks sites. Biochem[J]. Cell Biol, 2003, 81: 123-129. |
| [4] |
Teruakiv Konishi, Kuniaki Amemiya, Toshiyuki Natsume, et al. Anewmethod for the simultaneous detection of mammalian cells and ion tracks on a surface of CR-39[J]. J. Radiat. Res., 2007, 48: 256-261. |
| [5] |
闵锐, 倪瑾. h2ax活化与DNA双链断裂及辐射剂量的关系[J]. 生命的化学, 2006, 26(5): 427-429. DOI:10.3969/j.issn.1000-1336.2006.05.015 |
| [6] |
Giacomo Buscemi, Paola Perego, Nives Carenini, et al. Activation of ATM and Chk2 kinases in relation to the amount of DNA strand breaks[J]. Oncogene, 2004, 23: 7691-7700. DOI:10.1038/sj.onc.1207986 |
| [7] |
Eike Gallmeier, Jordan M Winter, Steven C Cunningham, et al. Novel genotoxicity assays identify norethindrone to activate p53 and phosphorylate H2AX[J]. Carcinogenesis, 2005, 26(10): 1811-1820. DOI:10.1093/carcin/bgi132 |
| [8] |
孙志娟, 范亚光, 赵永成, 等. 流式细胞仪检测电离辐射与γ-H2AX剂量效应关系的方法研究[J]. 中国工业医学, 2008, 21(4): 20-24. |
| [9] |
William M Bonner. Low-dose radiation:Thresholds, bystander effects, and adaptive responses[J]. PNAS, 2003, 100(9): 4973-4975. DOI:10.1073/pnas.1031538100 |
| [10] |
Liu Shu-Zheng. Nonlinear dose-effect relationship of different parameters in cancer cell lines[J]. Critical Reviews in Toxicology, 2005, 35: 595-597. DOI:10.1080/10408440500246843 |
| [11] |
AliSak, Sara Grehl, Patricia Erichsen, et al. γ-H2AX fociformation in peripheralblood lymphocytes of tumor patients after local radiotherapy to different sites of the body:Dependence on the dose-distribution, irradiated site and time from start of treatment[J]. Int.J.Radiat Biol, 2007, 83(10): 639-652. DOI:10.1080/09553000701596118 |
| [12] |
Emmal L Leatherbarrow, Jane V Harper, Francis A Cucinotta. Induction and quantification of g-H2AX foci following low and high LET-irradiation[J]. Int.J.Radiat.Biol., 2005, 82(2): 111-118. |
| [13] |
Chen RZ, Pettersson U, Beard C, et al. DNA hypomethylation leads to elevated mutation rates[J]. Nature, 1998, 395: 89-93. DOI:10.1038/25779 |
| [14] |
Zhou Chunxian, Li Zhongxiang, et al. DNA damage evaluated by γ-H2AX foci formation by a selective group of chemical/physical stressors[J]. Mutation Research, 2006, 604: 8-18. DOI:10.1016/j.mrgentox.2005.12.004 |