2. 中国药品生物制品检定所
随着现代医学的飞速发展, 对实验动物质量的要求会越来越高。包括对实验动物的遗传背景的了解、模型动物疾病发生机理、与人类疾病发生的异同、基因药物作用的机理与疗效等等[1]。
近交系小鼠以其独特的优点, 已广泛应用于医学、药物、免疫学及肿瘤治疗等领域的研究。自1990年以来, 我们用615小鼠为父本, ICR/JCL为母本, 按修饰单线系统繁殖, 培育出IRM -1、IRM-2近交系小鼠[2, 3], 为了观察IRM-1近交系小鼠的基因纯合性, 按照国标对IRM-1近交系小鼠进行了生化标记基因位点检测、皮肤移植试验、毛色基因测试, 以便确认IRM- 1小鼠的遗传相对稳定性与遗传纯合度。
1 材料和方法 1.1 材料 1.1.1 实验动物IRM-1小鼠23代, 10周龄, 雌雄各半, 16只, 用于生化标记基因监测; IRM-1雌性小鼠16只, 10周龄, 用于皮肤移植试验; 毛色基因检测:BALB/C近交系小鼠12只, 雌雄各半, 引自中国医学科学院动物所。
1.1.2 电泳器材与试剂电泳仪DY-600型中压电泳仪。醋酸纤维素薄膜(浙江黄岩产)。醋酸纤维素板(美国Helena实验室生产)。
1.2 方法 1.2.1 生化标记检测按照国家标准规定的方法[4], 对IRM- 1小鼠的Akp1等25个生化标记基因进行检测, 并分别用DBA/2、615、IRM-2近交系小鼠作对照。
1.2.2 皮肤移植法按照国家标准规定的方法[5]进行, 对IRM -1近交系小鼠进行基因纯度检测, 取8~9周龄、体重20~22g的健康同性小鼠进行自体移植和异体移植。观察100d, 是否发生移植排斥反应。
1.2.3 毛色基因纯合性IRM-1(雌雄各半)与已知基因白化小鼠BALB/C(雄或雌性)交配, 杂交F1代小鼠两周龄时, 根据毛色判断IRM一1小鼠基因的纯合性。按遗传学原理推断IRM-1小鼠的毛色基因型。
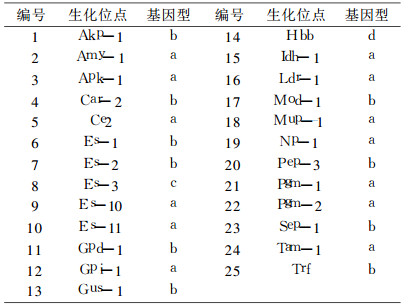
2 结果 2.1 生化标记基因结果按GB/T14927.1-2001及WHO(国际实验动物科学理事会)遗传检测操作规程, 对IRM-1近交系小鼠25个遗传生化标记基因的测定, 未发现杂合体, 所检遗传生化标记基因均为纯合体, 见表 1。
|
|
表 1 IRM-1小鼠25个生化标记基因的检测结果 |
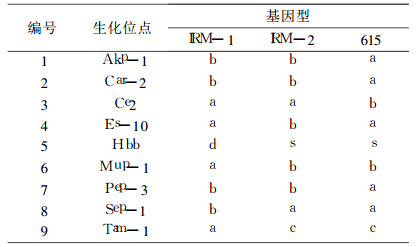
在所检测的25个遗传位点中, IRM-1与IRM-2近交系小鼠比较, 有20个生化标记基因与IRM-2近交系小鼠相同, 5个生化标记基因与IRM-2近交系小鼠有差异; IRM-1与615近交系小鼠比较, 有17个生化标记基因与615近交系小鼠相同, 8个生化标记基因有差异; IRM-2与615近交系小鼠比较, 有20个生化标记基因与615近交系小鼠相同, 5个生化标记基因有差异, 见表 2。
|
|
表 2 IRM-1、IRM-2、615小鼠生化标记基因的比较 |
按GB/T14927.2-2001遗传检测操作规程, 对IRM-1近交系小鼠进行的自体移植和异体移植实验, 观察100d, 始终有逆毛, 未发现排斥反应, 证明该品系组织相容性基因为纯合。
2.4 毛色基因纯合性结果IRM-1(黑色)与已知BALB/C小鼠(白色)进行交配, 所生子代毛色均为野生色, 根据遗传学原理推断IRM-1小鼠的毛色基因型应为aaBBCCDD。
3 讨论生化标记检查是评价近交系动物基因纯合程度的一个重要手段, 原理是在动物体内存在着一些同工酶和同种异构蛋白, 可依据它们在特定电场内携带的电荷不同, 采用电泳的方法将它们区分, 根据电泳带型既蛋白质的表现型推断其基因型及纯合度。生化标记具有敏感度高、准确和监测时问短等特点, 目前仍然是国内常用监测方法之一[1], 本实验结果显示, IRM-1与IRM-2近交系小鼠的Amy1(淀粉酶-1)基因型均为b/b型, 而b/b型极为罕见, 国内只有Tw小鼠基因型为b/b型[6], 在国外杰克逊研究所培育的近交系动物中, b/b型基因仅存在于CE/-和DE/J两个品系当中[7], 常见的近交系小鼠Amy1(淀粉酶-1)基因型为a/a型。
近交系小鼠还应具有相同的组织相容性基因。同系异体皮肤移植实验是利用免疫系统能够识别“自己”与“异己”的特性来鉴定组织相容性基因是否一致的重要手段[8], 本实验的结果显示, 自体移植和异体移植观察100d, 未见移植物脱落。证明该品系组织相容性基因为纯合。实验动物基因的多态性可以适应层出不穷的基因工程药和各种合成药的检测[7], 以及适应不断变化的病毒检测及各种新的生物制品检测, 为国标检测提供丰富的实验动物, 来适应高科技的发展需求。
| [1] |
李军林, 张耀光, 魏私. 近交系小鼠的遗传监测[J]. 动物医学进展, 2001, 22(2): 42-44. DOI:10.3969/j.issn.1007-5038.2001.02.012 |
| [2] |
王月英, 周继文, 王汝勤. IRM-2近交系小鼠的生殖生长特性[J]. 中国实验动物学报, 2001, 9(2): 103-106. DOI:10.3969/j.issn.1005-4847.2001.02.008 |
| [3] |
周继文, 王月英, 刘双环. IRM-2近交系小鼠的遗传监测[J]. 中国实验动物学杂志, 2000, 10(4): 206-209. DOI:10.3969/j.issn.1671-7856.2000.04.004 |
| [4] |
GB/T14927.1-2001, 实验动物近交系小鼠、大鼠生化标记检测方法[S].
|
| [5] |
GB/T14927.2-2001, 实验动物近交系小鼠、大鼠皮肤移植法[S].
|
| [6] |
管彤, 王凤山, 刘双环. 野生来源TW近交系小鼠的遗传监测[J]. 中国比较医学杂志, 2004, 14(4): 205-207. DOI:10.3969/j.issn.1671-7856.2004.04.003 |
| [7] |
刘双环, 马丽颖, 王凤山. Tw近交系小鼠的遗传鉴定和罕见基因分析[J]. 中国实验动物学报, 2007, 15(1): 1-4. DOI:10.3969/j.issn.1005-4847.2007.01.001 |
| [8] |
章金涛, 康巧珍, 薛敬礼. 新近交系HLC小鼠的遗传监测[J]. 郑州大学学报(医学版), 2002, 3(4): 450-452. DOI:10.3969/j.issn.1671-6825.2002.04.020 |