电离辐射是自然界普遍存在的环境致突剂和致癌剂, 并广泛应用于癌症治疗。尽管对电离辐射的生物学效应进行了长期的研究, 仍对受电离辐射作用后细胞内的信号事件知之甚少。近年对AT(Ataxia Talangectasia, 一种电离辐射反应异常敏感的遗传病)的研究发现, 其cDNA序列与磷脂酰肌醇-3激酶(Phosphatidy linositol-3Kinase, PI-3K)具同源关系[1], 后者是当今引起广泛关注的一种新的细胞内信号物质, 与多种跨膜受体的信号传导有关, 影响多种原癌基因的表达, 在细胞的分化增值, 免疫系统的发生等重要的生命活动中可能居重要位置[2]。现已发现愈来愈多的蛋白激酶与PI-3K同源, 形成所谓“PI-3K超家族”[3], 它们都与细胞的基本生命活动有关, 相当一部分参与异常辐射反应。
我们设想如果抑制PI-3K, 可能使细胞的辐射敏感性发生变化。本课题应用PI-3K的特异性抑制剂WT作用于不同细胞, 从细胞存活, DNA代谢和转录因子等不同水平研究了WT的辐射增敏作用。
1 材料与方法 1.1 材料小牛血清购自华美生物工程公司, RPMI1640培养液, WT, 二甲基亚砜, 低溶点琼脂均为SIGMA公司产品, 60Coγ射线辐照装置, 第二军医大学放射医学研究所; 溴化乙锭(EB)瑞士Fluka公司; 蛋白酶K由华顺公司进口分装; 低熔点琼脂胶块制作模槽BIORAD公司产品; 2-200型电泳仪, BIORAD公司产品; SHZ-22水浴恒温器, 江苏泰仓医疗器械厂生产; TGL-1型台式低温离心机, 上海安亭科学仪器厂生产; TR-A紫外线检测仪, 上海顾村厂生产; MECROTEK-6E光学扫描仪, 台湾中晶公司生产; 586MMOL/LX-200微型计算机(兼容机), ONE-DISCAN电泳凝胶图象分析软件(CSP公司); 含kB位点和CREB位点的双链寡核苷酸(CRE:5'CAT TCGA TGACATCA GTAGGGTG3', 3'CTA AGCT ACTGTAGT CATCCCAC5';kB:5'CAAC AGA GGGGA CTTTCC GAGAGC3', 3'GTT GTCT CCCCT GAAAGG CTCTCG5')均由中国科学院上海植物生理研究所合成, 32P-γATP[腺苷5'(γ-32P)三磷酸盐]北京市亚辉生物医学工程公司产品, 活度浓度>185TBq/ mmol/Lol。T4多核苷酸激酶及其反应缓冲液, SIGMA公司产品; 5M乙酸铵溶液, 上海华顺生物工程公司产品。Hepes, SIGMA公司产品; 苯甲酸磺酰氟(PMSF), SIGMA公司产品; DTT, SIGMA公司产品; 抑蛋白酶肽(Aprotinin)和抑蛋白酶肽(leupeptin), Calbiochem产品; Tris碱, Watson Biomedical公司产品; 30%聚丙烯酰胺, 过硫酸铵, SERVA公司产品; TEMD, SIGMA产品; 医用X光胶片, 日本富士产品; Poly(dI-dc), SIGMA产品; ProteinⅡ型垂直凝胶电泳装置(B-R)公司产品; 国产ZC-201型放射型沾染探则仪; 自制真空干胶装置。其余常用试剂(KOH、MgCl2、硼酸、乙醇等)常用试剂均为国内AR级产品。
1.2 方法 1.2.1 WT对受照细胞存活率的影响以含10%小牛血清的RPMI1640培养基培养小鼠LP3细胞。以DMSO溶解WT加入培养液, 细胞在含50μmol WT的培养液中温育1h, 接受不同剂量γ射线照射, 在该培养液继续温育17h后, 更换不含WT的新鲜培养液, 培养5~7d后计数细胞克隆形成。
1.2.2 WT对受照细胞DNA损伤修复的影响参阅WlodekD方法[4], 进行DNA双链断裂分析。收集对数生长期的LP3细胞, 调整细胞浓度; 将细胞悬液与1%低溶点琼脂1:3混合, 迅速注入准备好的制胶槽中, 4℃冰箱10min, 轻轻推出含细胞胶块, 接受20Gy60Coγ射线一次性照射, 继续在含WT培养液中温育不同时间取出胶块, 置1ml溶胞液中于60℃水浴置24h, 间或颠倒数次, 以4℃TE溶液洗3遍, 置0.5mol/LEDTA溶液(pH8.0)中保存待用。制备电泳琼脂糖凝胶, 以180°脉冲场琼脂糖凝胶电泳17h, 将电泳凝胶在紫外检测仪下进行激发荧光照相, 扫描仪扫描, ONE-DISCAN凝胶分析软件进行荧光图象数据分析。
1.2.3 WT对受照细胞转录因子NF-kB和CREB的影响参阅SinghSP方法[5], 进行转录因子的凝胶迁移率改变分析。合成含kB位点和CREB位点的双链寡核苷酸碱基序列, 以无菌双蒸水稀释, 退火, 制备放射性核苷酸探针。实验LP3细胞样品受5Gy照射及WT作用后, 提取核蛋白, 与标记探针进行结合反应, 上样行非变性聚丙烯酰氨凝胶电泳。真空干胶, 低温环境中进行放射自显影, 照相扫描, 数据分析。
2 结果和讨论 2.1 WT对受照细胞存活增敏效应以50μmol/LWT作用细胞, 在不同剂量γ射线照射后继续作用17h时间, 更换培养液, 5~7d后细胞克隆数均低于单纯受照组, 显示WT增加细胞的辐射损伤(图 1)。每一剂量的存活数值均小于单独照射存活, 剂量存活曲线显示其增敏比约1.2左右。
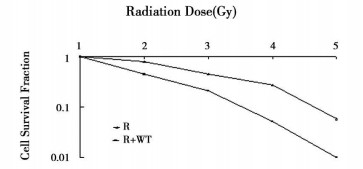
|
图 1 照射剂量与细胞存活率 |
一般公认肌醇三磷酸(IP3)及甘油二脂(DG)等为胞内信使。近年发现PI-3K可以催化肌醇环与D3位磷酸化, 生成的相应的D3磷酸产物不是已知磷脂信号通路的成份, 已有愈来愈多的证据显示这一个新的磷脂信号通路通路[1]。共济失调毛细血管扩张症(AT)一个共同特征是对电离辐射敏感, 对其基因的克隆显示该基因属于PI-3K相关激酶家族, 这一类激酶中相当一部分与辐射反应异常有关[1]。我们的实验显示PI-3K的特异性抑制剂WT的确可以增加几种细胞的辐射敏感性。单独WT对几种细胞并不显示明显的损伤作用, 但如果WT和电离辐射共同作用于细胞, 则显现出明确的辐射增敏效果。
2.2 WT对受照细胞DNA损伤修复的影响应用改进的低电场强度普通琼脂糖凝胶电泳检测受20Gyγ射线照射后LP3细胞DNA双链断裂及其修复。随着受照后时间的延长, 由加样孔进入凝胶的DNA小片断逐渐增多, 在所观察的照后0.5, l, 3, 6h几个时间点, 受50μmol/LWT作用的细胞DNA经电泳后进入凝胶的量均高于对照(图 2)。照后不同时间进入凝胶的DNA数量, 片段大小, 分布位置都有所区别, 说明WT的辐射增敏作用与其增加细胞的DNA损伤抑制其修复有关。
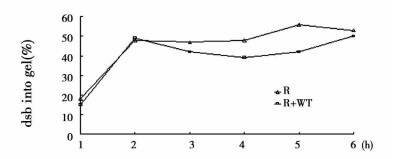
|
图 2 照射后不同时间进入凝胶的DNA比例 |
造成DNA损伤的最主要物理因素之一是电离辐射, 它使DNA产生单链, 双链断裂, 形成各种二聚体等, 其中DNA双链断裂(double strands break, dsb)尤被重视, 被认为是辐射造成细胞死亡的最主要事件[8]。我们用改进的琼脂糖凝胶电泳检测到WT增加受照细胞DNAdsb水平, 提示WT的辐射增敏作用可能与增加DNA损伤, 抑制其修复过程致细胞出现辐射增敏现象。
2.3 WT对受照细胞转录因子NF-kB和CREB的影响LP3细胞的辐射相关多功能转录因子NF-kB的结合活性在受5Gyγ射线照后6h内都经历了一个由低升高, 然后降低的过程, 大概在照后3h是这个变化的峰值。50μmol/LWT基本上完全抑制了NF-kB受照后的变化过程(Fig. 3)。
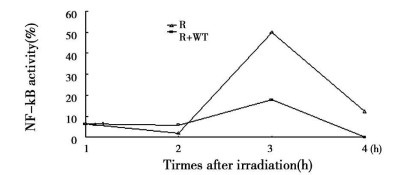
|
图 3 照射后不同时间NF-kB的结合活性 |
真核基因表达是严格按一定时间, 空间顺序发生的事件, 其调节机制可在复制、转录和转录后, 翻译和翻译后各级水平进行。mRNA转录是真核基因表达调节的基本控制点, 究竟通过何种机制调节基因的激活过程和转录程度, 尚不十分清楚, 而顺式作用元件与反式作用因子的相互作用对真核基因转录有重要的调节作用是目前公认的一个事实, 我们的实验提示WT可能在转录水平影响细胞的辐射反应。
核因子KB(Nnclear Factor-kB, NF-kB)是一个多功能转录因子, 由p50和p65亚基组成, 与一调节亚基I-kB形成复合物, 在一定条件下复合物解聚在胞浆一胞核信息传递中起重要作用。它在细胞浆中被激活后从胞质易位到核中与kB基因序列结合发挥转录调控作用。其功能可分两大类:①胞浆一胞核间信号传递; ②激活早期反应基因, 与免疫反应, 急性期反应和炎症过程相关。已有证据说明多种生物理化因素(包括电离辐射)可使NF-kB增加, 多种与细胞生命相关的重要基因表达增加[9]。
WT作用对NF-kB受照后变化的影响详细发生机制以及与WT辐射增敏的确切关系仍需进一步研究, 电离辐射可能通过一些信号传导途径激活NF-kB, 进而促使一些与DNA损伤修复和细胞其它防御机制有关的基因活动, 以减轻辐射损伤, WT有可能是通过阻滞这一过程的早期阶段而发生辐射增敏效应。
| [1] |
Savitsky A, Barshira A, Gilad S, et al. A single Ataxia Tel-angiectasia gene with aproduct similar to PI-3 kinase[J]. Science, 1995, 268: 1749-1753. DOI:10.1126/science.7792600 |
| [2] |
Lucia ER, Lewis CC. The role of phosphoinositide 3-kinase lipid products in cell function[J]. J Biol Chem, 1999, 274(13): 8347-8350. DOI:10.1074/jbc.274.13.8347 |
| [3] |
Abraham RT. Phosphatidy lirositol 3 kinase related kinase[J]. Curr Opin Immol/Lun, 1996, 8: 412-418. DOI:10.1016/S0952-7915(96)80132-4 |
| [4] |
Bramme I, Zoller M, Dikomey E. Relationship between cel-lular radiosen sitivity and DNA damage measured by comet as-say in human normal, NBS and AT fibroblasts[J]. Interna-tional Journal of Radiation Biology, 2001, 77(9): 929-938. DOI:10.1080/09553000110064222 |
| [5] |
Yan Y, Black CP, Cao PT, et al. Gamma-irradiation-in-duced DNA damage check point activation involves feedback regulation between extracellular signal-regulated kinase 1/2 and BRCA1[J]. Cancer Res, 2008, 68(13): 5113-5121. DOI:10.1158/0008-5472.CAN-07-5818 |
| [6] |
KeTTh CT, Schereiber SL. PI-3K related kinase, DNA re-pair, recombination and cell cycle checkpoint[J]. Science, 1995, 270: 50-51. DOI:10.1126/science.270.5233.50 |
| [7] |
Park J, Kunjibettu S, McMahon SB, et al. The ATM-relat-ed domain of TRRAP is required for his tone acetyl transferase recruitment and Myc-dependent oncogenesis[J]. Genes & Dev, 2001, 15: 1619-1624. |
| [8] |
Lobrich M, Ikpeme S, Haub P, et al. DNA double strand breaks induction in yeast by X-rays and αparticlesmeas-ured by pulsed field gel electrophoresis[J]. Int J Radiat Biol, 1993, 64: 539-546. DOI:10.1080/09553009314551751 |
| [9] |
Haase MG. Klawitter Sustained elevation of NF- κB DNA binding activity in radiation-induced lung damage in rats[J]. International Journal of Radiation Biology, 2003, 79(11): 863-877. DOI:10.1080/09553000310001632903 |



