2. 中国疾病预防控制中心营养和食品安全所
电离辐射往往通过间接或直接损伤DNA而诱发细胞损伤、突变和癌变。单细胞凝胶电泳(SCGE), 是一种检测哺乳动物细胞DNA断裂和损伤的新技术。该技术已广泛应用于放射生物学、遗传毒理学、生物监测及细胞凋亡等领域的研究。笔者应用SCGE方法观察不同剂量整体照射动物照后不同阶段血淋巴细胞DNA链损伤的特征性改变, 并探讨该方法作为应用于受照后辐射生物剂量计的可行性。
1 材料与方法 1.1 实验动物C57BL/6j小鼠150只, 6~8周龄, 体重(20.5 ±1.23)g, 购于北京大学医学部实验动物中心。实验动物许可证号:SYXK(京)2006-0025。采用盒养方式饲养。实验动物自由饮食饮水。
1.2 辐射损伤模型制作及分组辐射损伤模型小鼠在北京师范大学辐射中心进行60Co源照射。吸收剂量率为0.5G y/min。实验动物随机分为5组:假照射组、1.0 Gy组、2.0 Gy组、4.0 Gy组和8.0 Gy组, 每组30只小鼠。于照射后24h(急性损伤期)和22d (损伤恢复期)分别眼眶取血1 ~ 1.5ml放入肝素抗凝管中。
1.3 外周血淋巴细胞分离取肝素抗凝血0.8ml, 沿离心管加在等体积淋巴细胞分离液面上, 3 500r /min离心10min, 吸取中间层淋巴细胞。
1.4 碱性SCGE电泳参照文献[1]实施SCGE。电泳所用试剂均购自Sigma化学公司。①取10μl淋巴细胞加入90μl% LMA混匀后铺在载玻片上, 盖上盖玻片, 置4℃5 min固化后移去盖玻片。②将载玻凝胶片浸于冷冻裂解液中(1%Triton X100, 10%DMSO), 4℃下避光裂解1.5h。用蒸馏水漂洗2次。③将凝胶板水平排放入电泳槽中, 电泳液为新配制的0.03 Mol/ LNaOH+2.0 mMol/LEDTA溶液。用电压25V, 电流300 mA, 室温避光下电泳20 min。④取出凝胶板用中和缓冲液漂洗3次和冷存无水乙醇脱水10 min。用质量浓度为50 μg/ml溴化乙锭60μl成像。
1.5 彗星图像的分析采用专业软件IMI1.0进行分析, 每张凝胶片各分析50个细胞彗星”图像, 包括:彗星全长(CL)、彗星分布矩、彗星头部DNA%(HDNA%)、尾部DNA%(TDNA%)、头长(HL)、尾长(TL)、尾/头长比值、尾矩(TM)、尾重心(TW)和Olive尾矩(OTM)作为分析指标。
1.6 统计学分析各分析数值采用平均数±标准差(x±SD)表示, :用SPSS 1210统计软件对上述指标进行单因素方差分析和组间比较。
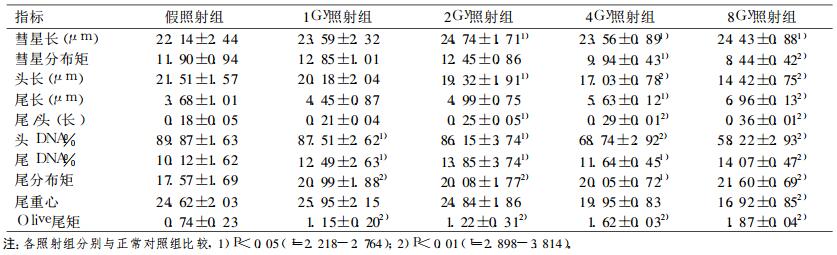
2 结果 2.1 整体照射后24h (急性辐射损伤期)小鼠淋巴细胞DNA迁移的各项指标变化(表 1)|
|
表 1 整体照射后24h (急性辐射损伤期)各组小鼠淋巴细胞DNA迁移各项指标n=50 (x±SD) |
各组小鼠照后损伤24h血淋巴细胞DNA迁移各项指标显示, 照后急性辐射损伤期”彗星”头长随着照射剂量增加逐渐缩短, 尾长逐渐增加, 尾/头比值, 尾分布距和Olive尾距随着照射剂量增加而增加。伴随上述变化, ”彗星”头DNA%和尾DNA%亦发生反相性改变。上述改变幅度与受照剂量高低有关, 提示辐射可诱发辐射DNA迁移的各项指标变化, 其损伤具有特征性辐射剂量效应关系。
2.2 整体照射后22d (辐射损伤恢复期)小鼠淋巴细胞DNA迁移的各项指标变化(表 2)
|
|
表 2 整体照射后22d (辐射损伤恢复期)各组小鼠淋巴细胞DNA迁移各项指标n=50 (x±SD) |
表 2显示照射后22d, 各组小鼠淋巴细胞DNA迁移变化。各项DNA迁移变化特征与照射后24h (急性辐射损伤期)基本相似, 但变化幅度较急性损伤期更为显著。
3 讨论DNA链断裂的检测是研究DNA辐射损伤的方法之一[2]。早期建立的检测方法很多, 所获得的结果反映了群体细胞DNA损伤效应, 但这些方法灵敏度低, 操作条件不易控制, 不能对单个细胞进行分析。而SCGE是在核酸沉淀法Nucleoid Sedimen- tation和晕圈分析HoloAssay及弱碱性条件下发展的一种检测有核细胞DNA断裂技术, 其特点是在单细胞水平上对DNA损伤进行分析, 避免了只对细胞群体的DNA改变进行检测的不足。该方法适用范围广, 简便经济快速, 敏感性高, 可检出0.1个DNA断裂/109道尔顿。
辐射诱发DNA损伤多数是以DNA碱基损伤, 丢失以及DNA单链断裂和双链断裂的形式出现。由于多种环境影响因素包括吸烟习惯、感染、空气污染及饮食习惯等均可引起细胞DNA发生碱基损伤和丢失, 但发生细胞DNA双链断裂现象较少见[3]。由于电离辐射所致的DNA损伤导致各种类型突变, 像大片段缺失和重排等较大的改变可能是DNA双链断裂引起的, 故DNA双链断裂较单链断裂更具有辐射损伤特异性[4, 5]。
以往研究发现SCGE的DNA迁移长度与辐射剂量均呈直线模式。在一定辐射剂量范围内, 随着照射剂量增大, DNA双链断裂点越多, DNA片段越小, 尾长越长。由于高剂量辐射损伤的TL或CL往往出现损伤剂量-效应平台, 以及目测彗星长度主观因素较多, 故人为误差较大。而矩类指标, 如尾矩, Olive和尾/头长度比值等指标更灵敏和准确, 即使剂量较大时也不会出现平台, 符合辐射生物剂量学指标应具备的条件[6]。
本研究采用SCGE对不同剂量整体照射小鼠照后不同时段血淋巴细胞DNA损伤的特征性改变进行观察, 并探讨该方法用于受照后辐射生物剂量计的可行性。结果显示照后损伤24h DNA迁移指标”彗星”头长随着照射剂量增加逐渐缩短, 尾长逐渐增加, 尾/头比值, 尾分布距和Olive尾距随照射剂量增加而增加。伴随上述变化, ”彗星”头DNA%和尾DNA%亦发生反相性改变。上述表现提示辐射损伤早期即可诱发DNA迁移各项指标变化, 其变化幅度具有特征性辐射剂量-效应关系。辐射损伤恢复期上述各指标变化趋势特征与照射后急性辐射损伤期基本相似, 但变化幅度更为显著, 提示上述SCGE各指标特征性改变的稳定性。
综上所述, SCGE能定量反映不同剂量照射损伤和照射损伤后不同阶段所诱导的DNA损伤的不同反应, 其损伤程度与照射剂量呈良好的线性关系, 且具有损伤DNA迁移特征的稳定性。在放射生物学领域中, SCGE已非常广泛用于各种辐射损伤的检测、放射敏感性预测、辐射致癌致畸致突机制的探讨以及评价等多个领域, 有望成为放射生物学研究必不可少的检测工具之一。
| [1] |
Huang P, Olive PL, Durand RE. Use of the cometassay for assessment of drug resistance and its modulation in vivo[J]. Br J Cancer, 1998, 77(4): 412-416. |
| [2] |
Ejchart A, Sadlej-Sosnowska N. Statistical evaluation and comparison of comet assay results[J]. Mutat Res, 2003, 534(1-2): 85-92. DOI:10.1016/S1383-5718(02)00250-4 |
| [3] |
Marcon F, Andreoli C, Rossi S, et al. Assessment of individual sensitivity to ionizing radiation and DNA repair efficiency in a healthy population[J]. Mutat Res, 2003, 541(2): 122-128. |
| [4] |
UNSCEAR. 电离辐射源与效应卷Ⅱ效应[M]. 太原: 山西科学技术出版社, 2002: 648-695.
|
| [5] |
邹跃, 周湘艳. 淋巴细胞DNA双链断裂用于放射损伤检测的可行性研究[J]. 中华放射医学与防护杂志, 2004, 24(2): 120-122. DOI:10.3760/cma.j.issn.0254-5098.2004.02.010 |
| [6] |
刘强, 姜恩海, 李进, 等. 单细胞凝胶电泳检测DNA辐射损伤的剂量-效应关系研究[J]. 中华放射医学与防护杂志, 2006, 26(6): 31-34. |