2. 苏州大学基础医学与生命科学学院生物化学与分子生物学教研室, 生化工程研究所, 江苏 苏州 215123
电离辐射可直接或继发反应, 非特异性地作用于机体, 引起从细胞损伤到整个机体功能异常和器质性改变甚至死亡。从机体对其他应激事件的反应看, 辐射致损伤过程中, 自由基的产生及数量变化起着很大的作用[1]。近年来研究发现抗氧化剂可拮抗辐射损伤[2, 3]。本研究采用60Coγ射线照射制作动物模型, 观察PQQ对γ辐射损伤小鼠的血清、肝组织抗氧化能力的影响; 肝组织结构的改变, 以探讨PQQ用于辐射防护的理论依据。
1 材料和方法 1.1 主要试剂PQQ(上海复旦大学生物化学教研室惠赠); 小牛血清(上海华美生物公司); 丙二醛(MDA)、总抗氧化力(T-AOC)和超氧化物歧化酶(SOD)测定试剂盒(南京建成生物工程研究所)。
1.2 方法 1.2.1 动物与分组昆明小鼠(购自苏州大学实验动物中心), 8周龄, 雌雄各半, 体重(25 ±5)g。小鼠随机分未照射组1、照射前给药组、照射后给药组、照射未给药组, 每组10只。照射剂量5Gy。给药组每天经口灌服PQQ(按重量计2mg /kg), 连续喂养7d。照射组按要求进行60Coγ射线单次照射, 剂量率1Gy /min。
1.2.2 取材于照射后第8天, 小鼠摘眼球取血, 静置30min后, 3 500r /min, 离心10min, 收取上层血清, -20℃保存待测。颈椎脱臼处死小鼠, 取适量肝脏组织制成10 ﹪肝匀浆, 3 500r / min, 离心10min, 留取上清液, -20℃保存待测; SOD、MDA、T-AOC含量的测定参照试剂盒所附说明书进行检测。取肝脏, 生理盐水清洗后, 10%福尔马林固定, 制备HE染色肝切片。
1.3 统计学处理SOD、MDA、T-AOC含量, 采用SPSS 11.5统计软件包进行数据统计, 算出平均数±标准差, 两两对照用t值检验。
2 结果 2.1 照射小鼠血清SOD、MDA、T-AOC含量的变化(表 1)
|
|
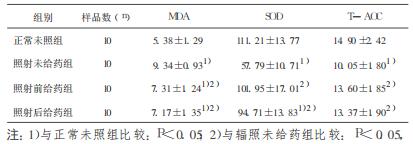
表 1 PQQ对60Coγ照射小鼠血清MDA、SOD、T-AOC含量的影响(x±s) |
SOD、MDA、T-AOC含量的变化(表 2)
|
|
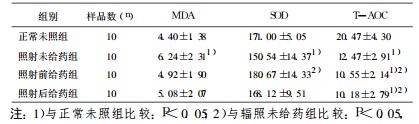
表 2 PQQ对60Coγ照射小鼠肝脏MDA、SOD、T-AOC含量的影响(x±s) |
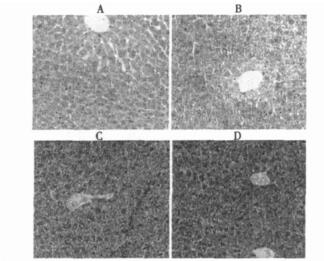
HE染色结果正常未照组小鼠肝组织切片中肝板排列整齐, 肝门处肝索放射状排列, 肝窦、肝小叶结构完整, 肝细胞大小一致, 胞质染色均匀(图 1-A); 照射未给药组小鼠肝板排列有点紊乱, 窦周隙缩小, 肝细胞体积稍大, 中央静脉周围肝细胞水肿, 肝细胞大小不一致, 基本未出现肝细胞有变性、坏死(图 1-B)。照射前给药组小鼠肝板排列紊乱, 窦周隙消失, 细胞大小不一, 部分胞质空泡化, 细胞核也大小不一, 有核浓缩和核溶解现象, 有部分细胞变性、坏死(图 1-C)。照射后给药组肝板排列紊乱, 部分肝细胞变性坏死, 其程度与照射前给药组类似(图 1-D)。
|
图 1 照射前后不同处理方法小鼠肝切片HE染色 A正常小鼠肝HE染色切片, B辐射未给药组小鼠肝HE染色切片, C照射前给药组小鼠肝HE染色切片, D照射后给药组小鼠肝HE染色切片 |
正常情况下, 机体内氧化与抗氧化反应处于动态平衡, 其重要原因之一是酶促反应具有可调节性, 当抗氧化酶的相应底物浓度上升时, 抗氧化酶更多被激活, 活性相应升高, 反之亦然。但抗氧化酶活性不会随底物浓度上升而无限制升高, 当底物浓度剧增时, 所有抗氧化酶短时间内迅速被激活, 其活性就不会继续升高, 甚至会出现消耗性降低。研究表明, 照射可使机体自由基的产生增加, 当自由基超过了机体的代偿能力, SOD防御系统遭到破坏, 其活性明显降低。MD A是脂质过氧化物的分解产物。可作为反映机体脂质过氧化水平的间接指标, 其血清和组织水平可反映机体细胞和组织受自由基攻击的程度。辐照动物各器官的损伤程度不同, 一般氧化代谢活跃的部位其抗氧化酶的活性越高, 而且不同部位的抗氧化酶对电离辐射的敏感性也不同, 刘永彪等[4]研究结果显示肝脏和骨髓细胞中抗氧化酶活性较高, 而肾脏中较低。本实验观察到γ射线辐射后小鼠血清和肝组织的MDA显著增加, SOD和T-AOC明显降低。说明γ射线照射损伤的氧化损伤是全身性的, 肝脏是重要的氧化应激器官。很多研究表明氧自由基在炎症的产生和发展中起一定的作用, 形成氧自由基-炎症相互促进的恶性循环[5]。从肝显微结构变化来看, 照射后小鼠肝板排列紊乱, 肝细胞水肿、变性甚至坏死现象, 出现了明显的肝组织损伤。
抗氧化剂的使用能达到一定的辐射防护作用。蒋世权[6]等研究表明黄蘑多糖的抗辐射作用机理与促进自由基清除, 抑制或阻断由自由基引发的脂质过氧化反应, 提高机体的抗氧化能力有关。梁莉[7]等研究显示苦豆子总碱可提高血清中超氧化物歧化酶(SOD)和全血中谷胱甘肽过氧化物酶(GSH-Px)活力, 降低肝脏中MDA含量, 同时使血清中谷丙转氨酶、谷草转氨酶活力降低, 在慢性辐射损伤模型中, 苦豆子总碱可增加外周血白细胞数, 增强机体的免疫功能。
PQQ是相对分子质量为330的小分子物质, 广泛存在于自然界。目前被认为是一种新的B族维生素[8], 参与机体代谢, 促进生长发育。Misra [9, 10]等通过基因工程菌研究显示PQQ能直接清除氧自由基及诱导其它自由基清除机制, 对γ射线照射引起的质粒DNA和蛋白损伤有保护作用。本研究发现, 照射前给药组和照射后给药组小鼠血清中MDA含量虽然高于正常未照组, 但显著低于辐射未给药组; 血清SOD、T-AOC明显高于单纯照射组, 其含量与正常未照组接近。照射前给药组和照射后给药组小鼠肝组织中MDA含量与照射未给药组比较均没有显著差异, 但其含量有所下降; SOD含量比照射未给药组显著增加, 与正常未照组比没有明显差异。说明PQQ能直接清除辐射产生的大量自由基, 同时激活其他抗氧化酶活性, 尤其SOD的合成, 增强自由基清除能力, 从而减轻辐射引起的氧化应激效应, 保护组织和细胞免受自由基的攻击。从HE染色肝组织切片看, 所有照射组小鼠都有不同程度的肝板排列紊乱, 局部出现肝细胞水肿, 变性、坏死现象, 照射前及照射后给药组小鼠的肝组织损伤比单纯照射组稍严重。分析原因:可能是辐射导致小鼠全身氧化应激, 肝细胞的正常结构及胞内外环境平衡被打破, 肝细胞损伤严重, PQQ应用反而加剧了肝损伤程度; 小鼠服用PQQ的时间短; 还可能由于PQQ在清除自由基的同时通过相关信号传递途经, 促发受损肝细胞的凋亡。
综上所述, PQQ能通过清除辐射引起的自由基, 激活机体抗氧化酶的活性, 对γ辐射小鼠起一定的防护作用。同时还提示PQQ的处理浓度、处理方式, 作用时间决定了其在生物学功能上的表现。因此, 进一步研究PQQ的吸收、代谢及在辐射引起肝损伤的修复作用机制, 为PQQ在临床上的应用提供重要的理论依据。
| [1] |
孙存普, 张建中, 段绍谨. 自由基生物学导论[M]. 合肥: 中国科学技术大学出版社, 1999: 194-200.
|
| [2] |
段伟, 毕良文, 秦继勇, 等. 辐射防护药物研究进展[J]. 中国辐射卫生, 2006, 15(1): 114-116. DOI:10.3969/j.issn.1004-714X.2006.01.069 |
| [3] |
陈栓芳, 周平, 郑颂阳, 等. 锌和维生素E对肝辐射损伤脂质过氧化和膜流动性的影响[J]. 中华放射医学与防护杂志, 2002, 22(1): 22-24. DOI:10.3760/cma.j.issn.0254-5098.2002.01.008 |
| [4] |
刘永彪, 刘颖, 赵杰, 等. SOD对肿瘤细胞凋亡影响和抗氧化损伤的研究: Ⅳ.SOD对荷瘤小鼠正常组织氧化损伤的保护效应[J]. 辐射研究与辐射工艺学报, 2004, 22(5): 297-302. DOI:10.3969/j.issn.1000-3436.2004.05.010 |
| [5] |
陈瑗, 周玫主编. 自由基-炎症与衰老性疾病[M]. 北京: 科学出版社, 2007: 44.
|
| [6] |
蒋世权, 叶飞, 苏士杰, 等. 黄蘑多糖的辐射防护作用及机理的初步探讨[J]. 中国辐射卫生, 2001, 10(2): 67-68. DOI:10.3969/j.issn.1004-714X.2001.02.002 |
| [7] |
梁莉, 李谦, 王婷, 等. 苦豆子总碱对亚慢性辐射损伤小鼠的防护作用[J]. 中药药理与临床, 2004, 20(5): 14-16. DOI:10.3969/j.issn.1001-859X.2004.05.009 |
| [8] |
Kasahara T., Kato T.. A new redox-cofactorvitamin formammals[J]. Nature, 2003, 422(6934): 832. DOI:10.1038/422832a |
| [9] |
Misra HS, Khairnar NP, Barik A, et al. Pyrroloquinoline-quinone:a reactive oxygen species scavenger in bacteria[J]. FEBS Lett, 2004, 578(1-2): 26-30. DOI:10.1016/j.febslet.2004.10.061 |
| [10] |
Rajpurohit YS, Gopalakrishnan R, Misra HS. Involvement of a protein kinase activity inducer in DNA double strand break repair and radioresistance of Deinococcus radiodurans[J]. Bacteriol, 2008, 190(11): 3948-3954. DOI:10.1128/JB.00026-08 |