人白细胞介素21(Interleukin-21, IL-21)是2000年新发现的细胞因子, 人IL-21基因定位于4q26-27, mRNA为566bp, 编码由162个氨基酸残基组成的多肽, 分子量为15KD[1]。IL-21是CD4+T辅助细胞的产物, 通过与T、B、NK等细胞受体结合, 选择性的修饰体液和细胞介导的免疫反应。国外研究报道[2], 体外重组的IL-21蛋白可增强抗CD3mAb活化的T细胞的抗肿瘤作用。本研究用我们已构建好的含人IL-21基因的重组腺病毒表达载体(Ad-IL-21)感染卵巢癌细胞ES-2, 观察IL-21基因对ES-2细胞的生长和细胞周期的影响, 探讨IL-21基因对卵巢癌细胞生长的抑制作用, 为进一步开展IL-21基因在肿瘤治疗中的应用奠定基础。
1 材料和方法 1.1 材料Ad-IL-21重组腺病毒表达载体(本室构建), Taq酶(大连宝生物公司), DNA提取试剂盒(北京博大泰克公司), RPMI1640培养基(Gibco公司), MTT(Amressco公司), PCR引物和分析纯二甲基亚砜(上海生工生物工程公司)。PCR扩增仪和酶标仪(美国Thermo公司), 凝胶电泳图像处理系统(美国Bio-Rad)公司, 流式细胞仪(美国Beckman公司, Altra Ⅱ)。
1.2 ES-2细胞内IL-21基因的表达鉴定将5×105ES-2细胞接种于6孔板中, 用已构建好的Ad-IL-21转染ES-2细胞。48h后提取细胞DNA, 经PCR扩增检测IL-21基因, 以未加Ad-IL-21的ES-2细胞为对照。上游引物:5'-ATG AGA TCC AGT CCT GGC-3', 下游引物:5'-TCA GGA ATC TTC ACT TCC-3'。扩增条件为94℃ 30 s, 58℃ 30 s, 68℃ 1 min, 共25个循环。PCR产物行1%琼脂糖凝胶电泳分析。
1.3 ES-2细胞培养及实验分组ES-2细胞用含10℅小牛血清的RPMI1640培养基, 在37℃含5℅CO2饱和湿度条件下培养。按以下方法分组①Ad-IL-21组:每孔加入含IL-21基因的重组腺病毒(滴度为1.6×108pfu/ml); ②Ad-lacZ组:每孔加入含lacZ基因(不含IL-21基因)的对照腺病毒; ③空白对照组:不做任何处理。
1.4 IL-21基因对ES-2肿瘤细胞生长的影响转染前一天用胰酶消化ES-2细胞并计数, 以103个细胞/孔加入96孔板, 在37℃含5℅ CO2饱和湿度的培养箱中培养过夜。Ad-IL-21质粒1μg感染单层细胞, 转染当天按不同分组处理, 每组做6个复孔。37℃、5%CO2培养箱内培养。从转染后每组分别于处理后第一天、第三天、第五天用MTT法测其在492nm波长下各孔的吸光值, 绘制生长曲线。
1.5 IL-21基因对ES-2肿瘤细胞的细胞周期影响转染前一天胰酶消化ES-2细胞, 以5 ×105个细胞/孔加入6孔板, 在37℃含5℅ CO2饱和湿度的培养箱中培养过夜。Ad-IL-21质粒5μg感染单层细胞。转染当天按不同分组处理, 37℃、5% CO2培养箱内培养48h, 收集细胞, 每个样本离心收集1 ×106细胞, PBS洗2次, 弃上清后加入二碘化丙啶(PI)800μl混匀。4℃避光反应30min, 尼龙网过滤, 流式细胞仪488nm波长上样检测。
1.6 统计方法采用Excel软件进行方差分析比较存活细胞数量, 以P < 0.05为有统计学意义。
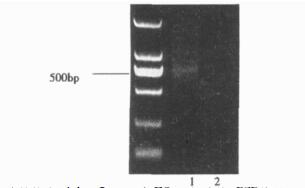
2 结果 2.1 转染Ad-IL-21后ES-2细胞中IL-21基因的表达鉴定以提取的ES-2细胞DNA为模板PCR扩增IL-21基因, 从图 1可以看到对照组ES-2细胞中没有扩增出片段, 而转染了A d-IL-21重组腺病毒的ES-2细胞中扩增出了预计的IL-21基因片段(493bp), 表明Ad-IL-21成功转染了ES-2细胞。
|
图 1 Ad-IL-21转染ES-2细胞后IL-21基因鉴定 1道是转染Ad-IL-21后ES-2细胞的PCR结果 2道是对照ES-2细胞的PCR结果 |
从细胞生长曲线可以看出, 空白对照组和Ad-lacZ组ES-2细胞数量随培养时间延长呈增加的趋势, Ad-IL-21重组腺病毒组的生长较慢, 在转染后第3天开始ES-2细胞生长明显缓慢(P < 0.05), 转染后第5天Ad-IL-21组的细胞生长基本稳定在一定水平(P < 0.05), 而Ad-lacZ组和空白对照组无明显差别, 见图 2。结果表明Ad-IL-21对卵巢癌细胞的生长具有抑制作用。

|
图 2 Ad-IL-21转染后ES-2细胞的生长曲线 |
从流式分析结果可见, 转染ES-2细胞后, Ad-IL-21组与空白对照组相比, G1期细胞增加14%, G2期和S期细胞分别减少6%和9%, 而Ad-lacZ组和空白对照组差别不大, 见表 1。表明IL- 21基因使ES-2细胞发生G0/G1期细胞周期阻滞。
|
|
表 1 Ad-IL-21转染后ES-2细胞的细胞周期 |
IL-21具有广泛的生物学功能, 能促进骨髓中的NK细胞增殖与分化并表达CD16分子, 与抗CD40mAb协同可刺激B细胞增殖, 与抗CD30mAb协同可刺激T细胞增殖[1], 单独作用或与其它刺激分子协同作用, 能增强效应T细胞及活化NK细胞的功能, 增加机体的天然免疫和特异性免疫。有研究报道[3], 将IL-21基因导入肿瘤细胞内, 可以促使肿瘤局部T细胞的增殖、活化、增加IFN-r的分泌, 促进NK细胞的分化成熟, 从而加强NK、CTL细胞的细胞毒活性, 发挥强大的抗肿瘤免疫作用。IL-21基因治疗有望在将来的肿瘤生物治疗中发挥重要作用。
选择合适的载体、安全有效的转染方式和保证外源性基因的有效表达, 是基因治疗的关键。目前国内外利用基因进行肿瘤基因治疗的研究一般采用质粒或逆转录病毒为载体[4]。由于体内有效的基因治疗需要足够高的感染率, 大部分逆转录病毒载体很难达到, 而腺病毒载体介导基因转移具有导入效率高、制备的病毒滴度高、对分裂和非分裂细胞均有感染性等优点, 因此重组腺病毒载体的体内抑瘤作用明显优于质粒载体和逆转录病毒载体[5]。本实验我们选择复制缺陷型腺病毒(E1区缺失)作载体, E1区是跟病毒复制有关的基因功能区, 因E1区的缺失使病毒DNA不能被复制和表达, 保证了转染的安全性。
为了确定腺病毒表达载体上基因的作用, 本研究以AdlacZ作为对照, 说明此抑制作用来自IL-21基因的表达, 而不是腺病毒本身。结果表明Ad-lacZ和空白对照组比较差异均无统计学意义, 提示腺病毒本身对肿瘤生长无影响。
本实验采用我们已经成功构建的Ad-IL-21重组腺病毒载体转染卵巢癌细胞, 结果显示, 腺病毒载体可有效的将外源性IL-21基因转入ES-2细胞, 且细胞的生长明显缓慢, 说明腺病毒介导的IL-21基因可显著抑制ES-2细胞的生长。
抑制肿瘤细胞生长的机理与细胞周期阻滞作用有关[6], 如果细胞提前从G1期进入S期, 细胞分裂则加快, DNA损伤修复不完全, 进而导致肿瘤发生; 如果G1期细胞增加使转入S期的细胞减少, 则肿瘤细胞的DNA合成受到抑制, 从而影响肿瘤细胞的分裂和增生。我们发现, 转染IL-21基因的ES-2细胞停滞于G1期, G2期和S期细胞减少, 表明IL-21基因有助于细胞保持在静止期, 有效的抑制肿瘤细胞的异常增生。本实验为卵巢癌的进一步基因治疗研究提供了理论基础和实验依据。
| [1] |
Parrish-Novak J, Dillon SR, Nelson A, et al. Interleukin 21 and its receptor are involved in NK cell expansion and regula-tion of lymphocyte function[J]. Nature, 2000, 408(8): 57-63. |
| [2] |
Asao R, Kudo T, Makabe K, et al. Antitumor activity of in-terleuk in 21 prepared by novel refolding procedure from inclu-sion bodies expressed in Escherichia coli[J]. FEBS Lett, 2002, 528(1-3): 70-76. DOI:10.1016/S0014-5793(02)03254-4 |
| [3] |
Dou J, Chen G, Wang J, et al. Preliminary study onmouse interleukin-21application in tumor gene therapy[J]. Cell Mol Immunol, 2004, 1(6): 461-466. |
| [4] |
He H, Wisner P, Yang G, et al. Combined IL-21 and low-dose IL-21 therapy induces anti-tumor immunity and long-term curative effects in a murine melanoma tumor model[J]. J Transl Med, 2006, 4(24): 1-16. |
| [5] |
范凌云, 谢庆军. 腺病毒载体的研究进展[J]. 中国生物制品学杂志, 2008, 21(2): 153-157. DOI:10.3969/j.issn.1004-5503.2008.02.020 |
| [6] |
Sun A, Bagella L, Tutton S, et al. From G0 to S phase:A view of the roles played by the retinoblastoma (Rb) family members in the Rb-E2F pathway[J]. J Cell Biochem, 2007, 102(6): 1400-1404. DOI:10.1002/(ISSN)1097-4644 |





