131I治疗Graves病安全、有效、无痛苦, 在某些西方国家已作为首选治疗方法, 在我国也有逐渐推广的趋势。但131I治疗Graves病后甲减的发生率有逐年上升的趋势, 其发病机制目前尚不清楚。笔者收集了70例行131I治疗的Graves病患者, 观察其131I治疗前后甲状腺自身抗体、细胞因子的变化规律及其与预后的关系, 以探讨131I治疗Graves病预后的影响因素。
1 资料与方法 1.1 临床资料收集2007年3月至2008年3月在本科确诊为Graves病并行131I治疗、资料齐全的甲亢患者70例, 其中男14例, 女56例, 年龄(40 ±14)岁。分别于131I治疗前、治疗后3、6、9、12月采集空腹血, 检测血清FT 3、FT4、sTSH、TRAb、TGAb、TMAb、IL-2、IL-6。预后分级(用于相关性分析):1-未愈、2-痊愈、3-甲减, 界定标准为131I治疗后12个月时血清检查结果:FT3、FT4仍高于正常为未愈; FT3、FT4、sTSH均在正常参考值范围内, 无临床症状体征为痊愈; FT4降低, sTSH升高为甲减。对照组30例, 均为健康查体者。
1.2 观察指标检测血清FT3、FT4测定用放免法, sTSH测定用包被管免疫放射法, 均采用上海奥瑞恩诊断试剂盒; TRAb测定用放射受体分析法, 试剂盒购自天津协和医药科技有限公司(进口药盒); TGAb、TMAb测定用放免法, 试剂盒购自上海放免所; IL-2、IL-6测定用放免法, 采用天津九鼎放免试剂盒。正常值参考范围:FT3 2.10~5.60pmol/L, FT4 9.11~ 25.47pmol/L, sTSH0.36~5.66mIU/L, TRAb < 5U/L, TGAb < 30%, TMAb < 15%, IL-2(4.8 ±1.5) ng/ml, IL-6(81.3 ± 50.46) pg/ml。
1.3 131I用量131I治疗用量=计划量×甲状腺重量÷甲状腺最高摄碘率, 计划量按每克甲状腺组织2.96~3.33MBq (80 ~90μCi), 并结合年龄、病程、甲亢程度、131I生物半衰期上下浮动0.37 MBq/g (10μCi/g)甲状腺组织, 甲状腺重量估算采用B超与触诊相结合。
1.4 统计学处理运用SPSS13.0版软件进行统计学处理, 数据以x±s表示, 均数比较选项中选择方差齐性检验, 相关分析选择Person相关。
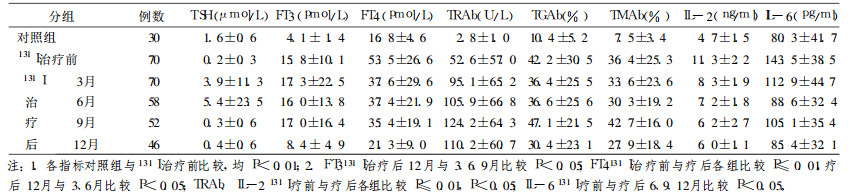
2 结果 2.1 各观察指标检测结果30例正常对照和70例Graves病患者131I治疗前后各观察指标检测结果见表 1。
|
|
表 1 对照组和Graves病患者131I治疗前后各观察指标检测结果(x±s) |
|
|
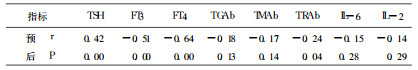
表 2 预后与131I治疗前各观察指标的相关性分析 |
|
|
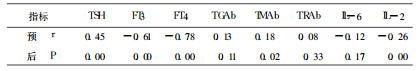
表 3 预后与131I治疗后各观察指标的相关性 |
Graves病属于自身免疫性甲状腺疾病(AITD), 是最常见的器官特异性自身免疫性疾病, 其环境因素、遗传因素、自身免疫变化过程等发病机制均未完全阐明。文中表 1示Graves病患者131I疗前TRAb、TGAb、TMAb、IL-2、IL-6均显著高于正常对照组, 131I治疗后除TRAb呈逐渐升高趋势外, 其余四项指标均呈逐渐降低趋势。TRAb、TGAb、TMAb、IL-6均在131I治疗后9个月时有一波动高峰, 考虑与滤泡上皮细胞破坏大量释放自身抗原, 刺激机体产生自身抗体及细胞因子有关。本研究结果显示TRAb、TGAb、TMAb、IL-2、IL-6均参与Graves病自身免疫反应, 131I治疗9个月以后免疫状态才逐渐趋于稳定, 但12个月时尚不能完全恢复正常。与刘世娟等[1]报道结果相似。
目前普遍认为Graves病是TRAb引起的甲状腺功能亢进为主要特征, 甲状腺组织破坏不明显的一种AITD[2]。TGAb、TMAb的存在反映甲状腺自身免疫状态的存在, 与Graves病的发病无直接关系[1]。文中表 2、3显示, 预后与131I治疗前TRAb呈负相关, 与TMAb不相关, 而与131I治疗后TRAb不相关, 与TMAb呈正相关; 预后与131I治疗前、后TGAb均不相关。由此推测131I治疗前TRAb表现为甲状腺刺激性抗体(TSAb)的功能, TMAb不表现破坏性作用, 而131I疗后上皮细胞大量破坏, TSH受体明显减少, TRAb相对过量, 虽数量增加, 但TSAb功能不占优势, 相反TMAb数量未显著增加, 但其破坏性作用开始趋向主导地位。目前认为在存在甲亢的情况下, 一般都把TRAb阳性视为TSAb阳性[3]。本研究结果显示此观点在131 I治疗后不成立, 分析TRAb、TMAb功能变化的原因, 认为可能与二者所含各种组分或与之功能有关的细胞因子对131I敏感性不同有关, 还可能与131I疗后IL-2水平逐渐降低有关, Pimentel Muinos等[4]研究发现IL-2在Graves病中具有抑制患者TMAb和TGAb合成的作用。本研究结果支持TRAb是导致Graves病发病的直接原因, TGAb、TMAb与Graves病的发病无直接关系的观点[1], 并显示TMAb与131I疗后甲减的发生有关, 131I疗后1年内TRAb升高对预测近期预后临床价值不大。
有学者研究[5]表明TRAb是由Th2型细胞因子诱导产生的, 因而Graves病主要表达的是趋向于体液免疫应答。IL-2由Th1细胞分泌, 介导细胞免疫应答。还有文献研究认为在Graves病不同时期, Th2与Th1的优势可以互相转化, 有时呈现Th1/Th2的双重表达[6]。本研究结果显示预后与131I治疗前IL -2不相关、TRAb呈负相关, 与131I治疗后TRAb不相关、IL-2呈负相关, 支持131I治疗前TRAb (Th2)占优势, IL-2较正常显著升高只表示患者存在明显的自身免疫异常, 131I治疗后随着甲亢缓解、甲减出现, 由Th2占优势逐渐转为Th2与Th1双重表达。预后与131I治疗前、后IL-6均不相关, 与王琛等[7]报道一致, 认为IL-6只参与自身免疫反应, 不直接参与Graves病发病。
表 1sTSH变化规律显示本组131I治疗后3~6个月是早发甲减的高发期, 9~12个月逐渐恢复。FT3、FT4 3~9个月持续高水平是早发甲减与滤泡上皮细胞破坏大量释放甲状腺激素的综合因素所致, 12个月时FT3、FT4才基本恢复至正常水平。131I生物半衰期为3~8d, 分析认为其对甲状腺滤泡上皮细胞直接破坏作用为期较短, 是早发甲减的主要原因; 其长期作用是上皮细胞大量破坏后释放了大量自身抗原, 刺激产生了大量自身抗体及细胞因子, 二者的细胞毒作用进一步不断破坏上皮细胞, 周而复始, 是131I疗后晚发甲减呈逐年递增趋势的主要原因之一。
本研究中发现, 131I治疗后甲状腺自身抗体及细胞因子变化存在较大的个体差异, 表 1所示为本组病例整体趋势, 少数病例并不完全符合, 甚至恰恰相反, 这可能也是目前相关研究结果不完全一致的原因。131I治疗前后甲状腺自身抗体及细胞因子的各种变化趋势对远期疗效的影响尚需大样本长期观察研究。
| [1] |
刘世娟, 王洪刚, 冯永堂, 等. 131I治疗Graves病免疫状态变化的规律及临床意义[J]. 潍坊医学院学报, 2005, 27(6): 410-413. |
| [2] |
Kopp P. The TSH receptor and its role in thyroid disease[J]. Cell MolLife Sci, 2001, 58: 1301-1322. DOI:10.1007/PL00000941 |
| [3] |
中华医学会内分泌学分会《中国甲状腺疾病诊治指南》编写组. 中国甲状腺疾病诊治指南——甲状腺功能亢进症[J]. 中华内科杂志, 2007, 46(10): 876-882. DOI:10.3760/j.issn:0578-1426.2007.10.035 |
| [4] |
Pimentel Muinos FX, Munoz-Fernandez MA, Fresno M, et al. Control of T Lymphoyte Activition and IL-2 Receptor Expression by Endogenously Secreted Lymphokines[J]. J Immunol, 1994, 152: 5714-5722. |
| [5] |
Kocjan T, Wraber B, Repnik U, et al. Changes in Th1/Th2 cytokine balance in Graves' disease[J]. P Flugers Arch, 2000, 440: 94. |
| [6] |
Miyauchi S, Metsuwra B, Onji M. Increased levels of serum interleukin-18 in Graves' disease[J]. Thyroid, 2000, 10(9): 815-819. DOI:10.1089/thy.2000.10.815 |
| [7] |
王琛, 何岚, 郭辉, 等. Graves'病患者血清IL-6和IL-8水平的研究[J]. 西安医科大学学报, 2000, 21(4): 325-327. DOI:10.3969/j.issn.1671-8259.2000.04.010 |