2. 辽宁中医药大学药学院;
3. 太原理工大学
丹参是临床最常用的活血化瘀中药, 现代医学认为丹参具有扩张冠状动脉、增加冠脉血流量、防止心肌缺血和心肌梗死等心血管作用[1], 以及用于治疗肝癌、胃癌、白血病、宫颈癌等多种疾病[2]。在丹参的主要抗肿瘤活性成分中, 二氢丹参酮Ⅰ (Dihydrotanshinone)是脂溶性的菲醌类成分之一, 可以通过抑制细胞增殖、促进凋亡以及促进分化等机制发挥抗肿瘤作用[3, 4]。但关于二氢丹参酮Ⅰ放射增敏作用的研究较少, 特别是对于肝癌的体内增敏实验研究未见文献报道。以荷H22肝癌小鼠为实验对象, 对二氢丹参酮Ⅰ对肿瘤生长时间延迟及小鼠肿瘤的抑制作用进行观察, 进一步探讨二氢丹参酮Ⅰ的放射增敏作用。
1 材料与方法 1.1 材料 1.1.1 动物和瘤株健康昆明种小鼠48只, 雌雄各半, 体重18 ~22g, 由中国医学科学院放射医学研究所实验动物中心提供。小鼠H22肝癌细胞由放射医学研究所实验动物中心提供。
1.1.2 药物二氢丹参酮Ⅰ由中国药品与生物制品检定所提供, 吐温-80(25%)溶解, 超声30min; 甘氨双唑钠为山东绿叶制药有限公司生产(批号2008 11162), 用生理盐水配成1.0mmol/kg, 现用现配。
1.2 实验方法 1.2.1 肿瘤接种无菌条件下抽取6~8 d传代接种的H22肝癌小鼠腹水, 用生理盐水稀释细胞悬液。用细胞计数板计数肿瘤细胞, 将细胞浓度调整为1.0×107/ml, 每只小鼠右下脚掌皮下接种0.2 ml。
1.2.2 动物分组及给药方法动物接种后一周, 按照肿瘤生长的大小均匀分组。分成5个组:空白对照组、单纯照射组、阳性对照组(甘氨双唑钠)、二氢丹参酮Ⅰ高剂量(20mg/kg)+照射组、二氢丹参酮Ⅰ中剂量组(10mg/kg)+照射组、二氢丹参酮Ⅰ低剂量组(5mg/kg)+照射组, 每组8只, 雌雄各半且分笼饲养。空白组:腹腔注射生理盐水0.3 ml/只; 阳性对照组:腹腔注射1.0mmol/kg甘氨双唑钠生理盐水溶液0.3ml/只; 二氢丹参酮Ⅰ给药组:用25%的吐温-80和生理盐水溶解, 超声30min, 配制高剂量组(20mg/kg), 后依次稀释到中剂量(10mg/ kg)和低剂量(5mg/kg)。阳性对照组和给药组(高、中、低), 分别在照射前30min腹腔注射0.3ml/只。照射后每隔一天测量肿瘤爪的长、宽、高, 计算肿瘤的相对体积。
1.3 试剂及仪器吐温-80:购自北京鼎国生物技术有限责任公司(Genview分装); 照射设备:加拿大GammaⅡ 40由放射医学研究所提供, 以137Cs为照射源, 照射剂量率0.78Gy/min; 游标卡尺:上海量器具厂。
1.4 照射方法每次4只小鼠, 清醒状态下照射。照射时将小鼠固定, 将接种肿瘤的后爪暴露于照射野中, 非照射部位用铅板遮蔽。照射剂量为5Gy。
1.5 观察指标照射后观察荷瘤鼠一般情况, 如进食、活动; 每隔一天测量肿瘤爪的长、宽、高, 计算肿瘤体积; 照射后22天处死小鼠, 剥取肿瘤并称重。计算抑瘤率、肿瘤生长延缓时间、增敏系数(EF)。抑瘤率=(1-给药组平均瘤重量/空白组平均瘤重量)×100%。肿瘤生长延迟时间(TGD):肿瘤体积生长至放射治疗前3倍所需时间为肿瘤3倍倍增时间(TGT3), 对照组(或实验组)不同剂量亚组的TGT3与空白对照组的TGT3之差为TGD。增敏系数(EF)=给药照射组TGD/单纯照射组TGD, EF>1提示有放射增敏效应。
1.6 统计学处理采用SPSS13.0软件进行统计分析。各组数值以(x±s)表示, 组间比较采用One-wayANOVA检验。
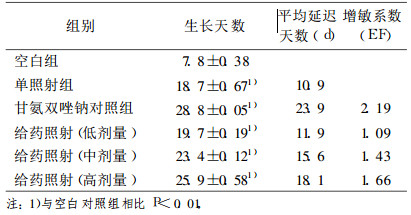
2 结果 2.1 二氢丹参酮Ⅰ对H22肝癌小鼠肿瘤的增敏作用照射后, 每隔一天测量一次肿瘤的体积, 记录对应天数。结果如下:空白对照组肿瘤体积增大至放射治疗前3倍所需天数为7.8d, 单纯照射组为18.7d, 给药二氢丹参酮Ⅰ高、中、低剂量组分别为25.9d、23.4d、19.7d, 给药二氢丹参酮Ⅰ的高、中、低剂量的增敏系数EF分别为1.66、1.43、1.09。结果表明, 二氢丹参酮Ⅰ各剂量组均能抑制肿瘤生长, 且高剂量(20mg/kg)的增敏效果比较明显, 抑制肿瘤作用随剂量的增加逐步增强。肿瘤体积3倍倍增时间和肿瘤生长延迟时间见表 1。对照组和各给药照射组肿瘤生长曲线见图 1。
|
|
表 1 肿瘤生长的延迟时间(x±s, n=4) |

|
图 1 各实验组荷瘤小鼠的肿瘤生长曲线 |
各实验组给药照射后, 观察未见明显的异常生理反应。在照射后22天, 处死小鼠, 剥取肿瘤并称重, 计算抑瘤率(见表 2)。抑瘤率=(1-给药组平均瘤重量/空白组平均瘤重量)× 100%。
|
|
表 2 不同实验组别对瘤重及抑瘤率的影响(x±s, n=4) |
丹参酮为中药丹参的脂溶性提取物, 有增加喜树碱、环磷酰胺对艾氏腹水癌、肝癌、肉瘤S-180、白血病L815抗癌活性的作用[5]。体外实验表明, 对艾氏腹水癌细胞有抗癌作用, 对人癌细胞株具有细胞毒杀伤作用和诱导分化作用[6]。二氢丹参酮Ⅰ是丹参的脂溶性成分之一, 具有菲醌结构, 其菲环可与DNA结合, 而呋喃环和醌类结构可产生自由基, 引起DNA损伤, 从而抑制肿瘤细胞DNA合成[7]。MosaddikMa的研究表明[8], 丹参酮通过抑制抗增殖细胞核抗原(PCNA)和细胞增殖相关的基因表达, 影响DNA多聚酶的活性, 抑制DNA合成, 从而抑制肿瘤细胞的增殖, 诱导细胞凋亡。
较为理想的放射增敏剂除了要求有较高的放射增敏比外, 其治疗剂量下的毒副作用越低越好。本实验中放射加药组小鼠在观察期间未见生活习性的异常改变。给药二氢丹参酮Ⅰ高剂量组抑瘤率为79.6%(P < 0.01)、中剂量组抑瘤率为78.1%(P < 0.01)、低剂量组抑瘤率为55.5%(P < 0.05)。表明二氢丹参酮Ⅰ不同剂量给药照射后, 对肿瘤的生长有一定的抑制作用, 小鼠瘤重量明显低于空白对照组, 较高剂量的二氢丹参酮Ⅰ对H22肝癌小鼠肿瘤的抑制作用较强。通过不同剂量的二氢丹参酮Ⅰ对H22肝癌小鼠肿瘤的放射增敏作用的初步研究表明, 二氢丹参酮Ⅰ中剂量(10mg/kg)、高剂量(20mg/ kg)组具有一定的放射增敏作用, 其增敏系数分别为:1.43、1.66。二氢丹参酮Ⅰ作为一种高脂溶性物质, 有利于渗透到肿瘤细胞内从而增加增敏剂的有效浓度[9], 很有希望成为一类有效的增敏剂, 但其抑制H22肝癌小鼠肿瘤生长及其放射增敏作用的机制有待进一步深入研究。
| [1] |
田葆萍, 袁志芳, 张兰桐. 丹参及其制剂的体内药代动力学研究概述[J]. 中国药房, 2003, 14(6): 375-378. DOI:10.3969/j.issn.1001-0408.2003.06.027 |
| [2] |
沈隽, 王照艳, 杜利力, 等. 丹参酮Ⅱ A对Hela宫颈癌细胞凋亡的影响[J]. 中国药房, 2007, 18(27): 2102-2104. DOI:10.3969/j.issn.1001-0408.2007.27.009 |
| [3] |
Wu X L, Yang K X, Yuaiir S L. Progress in in-vitro experiment research of the anti-tumor effect of tanshinone[J]. Chin J Inform TCM, 2006, 13(2): 94-97. |
| [4] |
Deng H Y. The survey of pharmacological study on dansh en and its active components[J]. Mod-Med Health, 2007, 23(12): 1812-1815. |
| [5] |
张玉五, 高亚菲. 活血化瘀药丹参抗肿瘤作用研究进展[J]. 西安医科大学学报, 1990, 11(9): 191-193. |
| [6] |
Chang W L, Chea C F. Cytotoxlc activity of tanshinone against human carcinoma cell lines[J]. Am J Chin Med, 1991, 191: 207-209. |
| [7] |
甄霞, 李运曼, 方伟蓉, 等. 丹参酮化合物对K562细胞的生长抑制及诱导凋亡作用研究[J]. 中国药理学通报, 2008, 24(7): 964-968. DOI:10.3321/j.issn:1001-1978.2008.07.029 |
| [8] |
Mosaddik M A. In vitro cytotoxicity of tanshinones isolated from Salvia miltiorrhiza Bungea gainst P388 lymphocytic leukemia cells[J]. Phytomedicine, 2003, 10(8): 682-685. DOI:10.1078/0944-7113-00321 |
| [9] |
Li R B, Wu Q, Xu S J. The effects of Dihydrotanshinone Ⅰ on the radiosensitization of QGY-7703 and SPC-A-1 cells[J]. J.Radiat Res.Radiat.Proces, 1998, 16(1): 29-33. |