放射治疗在头颈部恶性肿瘤的治疗中占据着重要地位。但放射治疗也是一把双刃剑, 杀伤肿瘤的同时, 也对正常组织产生损伤。损伤不仅局限于照射野内组织, 对全身机体特别是免疫功能也产生影响[1]。长期以来, 学者一直致力于寻找放射性损伤的影响因素, 从而减少损伤的发生率和程度。人体的表面和体内聚集着大量的正常菌群和条件致病菌, 病理情况下还有致病菌的侵袭。口鼻咽部更是细菌富集区, 菌群差异是否会对辐射后机体免疫系统紊乱带来影响, 本研究将在这一方面作初步探讨。
1 材料和方法 1.1 动物选择与分组各选取28只微生物学等级不同的动物, SPF级SD大鼠购自国家啮齿类实验动物种子中心, CV级SD大鼠购自复旦大学实验动物中心, 在开放环境中饲养一周。先各选8只作口咽培养和脾脏系数测定。余下平均分为8组, 每组5只。
1.2 主要试剂与实验仪器设备小鼠抗大鼠CD3+-FITC、CD4+ -Cy3、CD8+-PE为美国Southern Biotechnology Associates公司产品, 电子天平(Sartorius Bs2245), 流式细胞仪(FACSCCalibur双色流式细胞仪, BD), 离心机(Eppendorf5810R), 直线加速器(SIEMENSPRI MUS-M)。
1.3 质量控制SPF级动物饲养有严格的规定, 一经出笼后, 其生活饮食环境较难保证, 因此我们制定了严格的质量控制: ①SPF级大鼠出笼后, 单独送往实验室。取血、咽拭子采集等实验操作均在超净工作台上。②实验人员穿手术衣, 戴无菌手套、手术帽、口罩。③直线加速器房间紫外线消毒, 实验器械酒精浸泡, 操作台面擦拭消毒。④SPF级大鼠照射后置于中科院SPF级动物房外间, 饮水食物标准与SPF级动物相同。
1.4 实验方法 1.4.1 大鼠口咽细菌取样、培养、鉴定固定大鼠头, 拉开下颚, 消毒棉签在大鼠咽后壁取样, 无菌试管密封送细菌培养。具体为接种于营养肉汤血平板、SS平板, 35℃培养18~24h, 涂片染色后, 做生化反应。根据涂片染色结果, 选用相应的板条, 接种、孵育18~24h后读板。
1.4.2 脾脏脏器系数测定大鼠称重, 麻醉致死后, 打开腹膜将脾脏与周围组织分离, 迅速用天平称脾脏湿重。
计算脾脏脏器系数:大鼠脾脏系数=脾重/体重×1 000。
1.4.3 咽部照射大鼠复合氯胺酮腹腔注射麻醉, 左卧位, 右耳向上。6MX直线加速器照射, 放射野2cm×2cm(中心为大鼠鼻咽部), 源皮距100cm, 剂量深度2cm。按实验要求分别为0、10、20、30 Gy。放射后24~36h取材。
1.4.4 外周血淋巴细胞检测抗凝真空采血管取大鼠外周静脉血2ml, 标本在4 h内作染色处理。分设阴性对照管及试验管, 分别加入荧光抗体CD3+-FITC/CD4+-Cy5/CD8+-PE单抗, 在每管内加入抗凝全血100μl, 立即充分混均, 室温避光孵育30min, 加入FACS溶解液2ml裂解红细胞, 迅速混均置室温避光8~12min后, 以1 000r离心5min, 弃上清液, 加入2mlPBS洗涤2次, 弃上清液, 加入1mlPBS混匀将细胞悬浮后立即流式细胞仪检测。以三色荧光标准微球, 启动FACSCom软件, 利用Cellquest软件进行标本检测及分析。
1.5 统计分析结果以均数±标准差表示, 用SPSS 11.5 (SPSSInc, Chicago, IL, USA)软件进行统计分析, 两组间均数比较采用t检验, 多组差别比较用单因素方差分析(One-way ANOVA procedure), P < 0.05为有显著性差异。
2 结果 2.1 口咽菌群培养所有细菌培养阳性均为单菌种感染。① 8只CV级大鼠:细菌培养阳性率100%, 其中奇异变形杆菌阳性3例, 铜绿假单胞菌阳性2例, 金黄色葡萄球菌阳性1例, 亚利桑那沙门氏菌阳性1例, 聚团肠杆菌阳性1例。② 8只SPF级大鼠:细菌培养阳性率25%, 其中奇异变形杆菌阳性2例, 培养阴性6例。
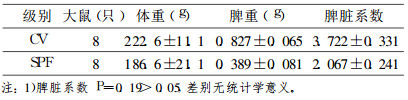
2.2 SPF级SD大鼠及CV级大鼠体重、脾脏湿重、脏器系数(表 1)|
|
表 1 SPF级大鼠及CV级大鼠脾脏系数比较1) |
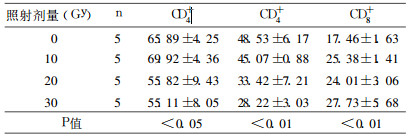
CV级大鼠在电离辐射后外周血T淋巴细胞总数和CD4+淋巴细胞均明显减少, 组间差异有统计学意义(P < 0.01或0.05), 随着辐射剂量上升下降明显, 与辐射剂量有密切的效应关系。CD8+淋巴细胞放射后上升, 组间差异有统计学意义(P < 0.01)。具体见表 2和图 1。
|
|
表 2 CV级大鼠不同照射剂量T淋巴细胞变化(%) |
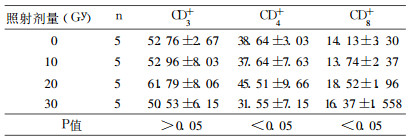
SPF级大鼠在电离辐射后外周血T淋巴细胞总数、CD4+和CD8+淋巴细胞亚群无明显下降趋势, 其中T淋巴细胞总数(CD3+)组间无差异(P>0.05)。具体见表 3和图 2。
|
|
表 3 SPF级大鼠不同照射剂量T淋巴细胞变化(%) |
2.4两种大鼠不同剂量照射外周血CD4+/CD8+比值的比较
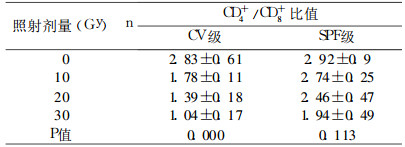
CV级大鼠在放射后其CD4+/CD8+比值呈明显下降趋势, 从放射前的2.8随辐射剂量的上升逐步下降至30Gy时的1.0左右, 组间差异有统计学意义(P < 0.01);SPF级大鼠放射后CD4+/CD8+比值随剂量虽有下降, 但下降趋势比较CV大鼠程度较轻, 统计学组间分析差异无统计学意义。具体见表 4。
|
|
表 4 CV级和SPF级大鼠不同照射剂量 |
T淋巴细胞亚群是构成机体免疫防御系统的重要因素。T淋巴细胞有两个主要亚群, 即辅助性T细胞CD4+和抑制性T细胞CD8+。CD4+具有调节免疫反应的活性, 辅助B细胞产生抗体, 分泌细胞因子, 而CD8+则有免疫抑制和细胞毒性作用。CD4+下降或CD8+升高均可使两者比例失调, 导致机体免疫功能缺陷。Anderson最早报道了电离辐射能引起免疫系统和淋巴细胞的严重损伤, 其外周血淋巴细胞构成及功能都有一定程度的损伤[2]。吕志新等对从事辐射工作人员进行研究, 发现CD4+/CD8++比值随着放射工龄的增加, 呈逐步减少趋势, 提示免疫功能的损害加重[3]。有学者研究发现食管癌、肺癌、鼻咽癌患者放疗后T淋巴细胞, 特别是CD4+T淋巴细胞明显下降, 尤其在鼻咽癌局部复发和远处转移患者中, CD4+/CD8+比值持续处于低水平[4, 5], 提示恢复T淋巴细胞功能及保持CD4+/CD8+正常比值能有助于提高恶性肿瘤的疗效。
人体的表面和体内聚集着大量的细菌。口腔、鼻腔鼻窦、鼻咽、口咽、下咽区更是细菌富集区。有研究表明菌群因素对机体免疫系统也会产生影响, 例如抗生素、饮食结构改变、奶粉喂养造成肠道微生物的变化与过敏性疾病的发生率上升直接有关[6]。有学者通过不同微生物级别动物的放射性损伤研究, 发现无菌动物(germ free, GF)与CV级动物对射线的反应有多方面的差别, 具体表现为:①导致50%发病率的最小剂量在GF动物中较高; ②在接受全身X射线照射(TBI)致死剂量后, GF动物比CV动物生存期长; ③导致肠道粘膜组织学变化的最低TBI剂量在GF动物中比CV动物高, 而造成骨髓损伤的TBI剂量相同。显示出GF动物比CV动物对射线有更好的耐受性[7, 8]。
为了了解菌群对于放射后机体免疫功能是否产生影响, 以及产生什么影响, 我们选取微生物等级差异较大的动物, 根据微生物等级标准和环境控制要求的不同, 清洁度由低到高依次为CV级动物、清洁级动物(clean animal, CA)、SPF级动物和GF动物。SPF级动物是根据我国国情而设立的最高清洁程度的动物, 必须饲养在经高效空气过滤的环境中, 净化级别达到10 000级, 质量控制符合国标GB14925-2001[9]。为了严格控制实验质量, 我们设定了质量控制步骤(详见材料和方法)。同时进行了实验比较, 咽部菌群培养结果显示, SPF级大鼠培养阳性率为25%, 阳性细菌为奇异变形杆菌。该菌为条件致病菌, 属于变形杆菌的一种, 常驻于宿主的鼻咽、消化道中, 在机体免疫功能正常情况下不致病。SPF级动物并不是无菌动物, 这与其他作者在SPF级动物胃肠道细菌培养的结果相一致。本组实验SPF级大鼠未发现常见的上呼吸道致病菌, 而CV级大鼠口咽细菌培养阳性率为100%, 并发现铜绿假单胞菌、金黄色葡萄球菌、亚利桑那沙门氏菌等致病菌, 证明SPF级大鼠和CV级大鼠在咽部微生物数量和种类上是有明显区别的。
为了避免SPF级动物由于较少接触免疫原导致免疫功能低下的缺陷, 我们进行了脾脏系数的比较, 脾脏是生物体内重要的免疫器官, 脾脏系数能反映了机体的免疫功能水平, 在机体免疫功能低下时, 脾脏系数会减小。我们分析表明SPF级大鼠的脾脏系数值相对较低, 统计学分析二者无明显差别, 但仍从一定程度上说明SPF级大鼠在微生物刺激程度上相对CV级大鼠较低。FCM显示虽然SPF级大鼠外周血成熟淋巴细胞CD3+、CD4+和CD8+淋巴细胞亚群均较CV级大鼠少, 但统计学分析CD3+、CD8+没有明显的区别。并且两种大鼠CD4+/CD8+比值相同, 均为2.9左右, 差别无统计学意义。与其他学者研究正常大鼠CD4+/CD8+比值一致, 说明两种大鼠未接受照射时免疫功能都是正常的[10]。
不同剂量照射后, CV级大鼠外周血T淋巴细胞总数、CD4+淋巴细胞均明显减少, CD8+淋巴细胞上升, 组间有明显差异(P < 0.01或0.05), 与辐射剂量有效应关系, CD4+/CD8+比值呈明显下降趋势, 组间差异明显(P < 0.01), 提示CV级大鼠机体免疫功能在辐射因素下明显损伤。而SPF级大鼠在电离辐射后外周血T淋巴细胞总数、CD4+和CD8+淋巴细胞亚群辐射后无明显下降趋势, T淋巴细胞总数组间无差异, CD4+/CD8+比值随剂量虽有下降, 但下降趋势比较CV级大鼠程度较轻, 统计学组间分析无明显差异, 提示SPF级大鼠放射性机体免疫损伤和CV级大鼠有所不同。
我们选取的两种动物在品系、性别和体重上均尽量保持相同, 放射前其全身免疫状态均为正常, 两者区别在于微生物级别的不同。SPF级动物由于其体内微生物较少, 口咽部细菌无致病菌, 咽部照射后全身免疫功能紊乱的影响程度较低, 提示菌群因素在辐射损伤中起着一定的作用。
本研究旨在对放射导致机体免疫功能改变的机体菌群因素作初步探讨, 随着实验动物学条件的成熟, 今后利用无菌动物, 使其感染人体常见细菌(悉生动物), 在此基础上进行研究, 将更有助于了解机体菌群对于放射导致的机体免疫功能影响的作用, 同时对免疫指标的检测将进一步丰富。
| [1] |
Busch D B. Radiation and chemotherapy injury:pathophysiology, diagnosis, and treatment[J]. Crit Rev Oncol Hematol, 1993, 15(1): 49-89. DOI:10.1016/1040-8428(93)90020-5 |
| [2] |
Anderson R E. Ionizing radiation and the immune response[J]. Adv Immunol, 1976, 24: 215-235. DOI:10.1016/S0065-2776(08)60331-4 |
| [3] |
吕志新, 冯宪勋, 徐西桥, 等. 放射工作者T淋巴细胞亚群测定[J]. 中国辐射卫生, 1999, 8(4): 241-242. |
| [4] |
周决, 曹世龙, 邱杏仙, 等. 放疗后肿瘤患者机体免疫功能改变初探[J]. 上海免疫学杂志, 1996, 16(1): 22-25. |
| [5] |
李虹, 马莉, 杨洁. 鼻咽癌患者外周血T细胞亚群及活化T淋巴细胞的检测及放疗后对其变化的影响[J]. 微量元素与健康研究, 2006, 23(3): 10-12. DOI:10.3969/j.issn.1005-5320.2006.03.005 |
| [6] |
Noverr M C. Does the microbiota regulate immune responses outside thegut?[J]. Trendin Microbiol, 2004, 12(12): 562-568. DOI:10.1016/j.tim.2004.10.008 |
| [7] |
Mclaughlin M M, Dacquisto M P, JacobusD P. Effects of the germ free state on responses of mice to whole-body irradiation[J]. Radiat Res, 1964, 23: 333-349. DOI:10.2307/3571614 |
| [8] |
Matsuzawa T. Survival time in germ freem ice after lethal whole bodyX-irradiation[J]. Tohoku J Exp Med, 1965, 85: 257-263. DOI:10.1620/tjem.85.257 |
| [9] |
郝光荣. 实验动物学[M]. 2版. 上海: 第二军医大学出版社, 2004.
|
| [10] |
陈华, 乔伯英, 李春海, 等. SPF、清洁及普通级大鼠部分生物学特性的比较[J]. 中国实验动物学杂志, 1999, 9(1): 28-33. DOI:10.3969/j.issn.1671-7856.1999.01.007 |



 ,
,